
科目: 来源: 题型:
在下列溶液中,各组离子一定能够大量共存的是
A.使酚酞试液变红的溶液: Na+、Cl—、SO42—、Fe3+
B.由水电离的c(H+)=10-12 mol·L—1的溶液:K+、Ba2+、Cl—、Br—
C.在pH = 1溶液中:NH4+、K+、NO3—、Cl—
D.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl-
查看答案和解析>>
科目: 来源: 题型:
在25℃时,水的电离达到平衡:H2O![]() H++OH-;ΔH>0,下列叙述正确的是
H++OH-;ΔH>0,下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量固体CH3COONa,平衡正向移动,c(H+)降低
D.将水加热,Kw增大,溶液仍为中性,pH不变
查看答案和解析>>
科目: 来源: 题型:
(4分)下列实验操作或对实验事实的叙述正确的是___________(填序号)。
①用碱式滴定管量取20.00 mL 0.10mol/L KMnO4溶液;
②用托盘天平称取10.50 g干燥的NaCl固体;
③各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘纸上称量;
④将未经湿润的pH试纸浸到某溶液中,过一会取出与标准比色卡比较,测得该溶液的pH;
⑤中和滴定中,锥形瓶用蒸馏水洗净后可直接往其中注入一定量的待测溶液;
⑥滴定时眼睛应注视锥形瓶内溶液的颜色变化而不应注视滴定管内的液面变化
查看答案和解析>>
科目: 来源: 题型:
(12分) 现有含FeCl2杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2固体,首先将其制成水溶液,然后按下图所示步骤进行提纯:
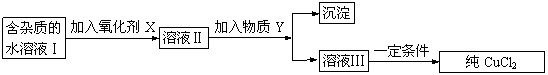
已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性,要将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH分别为6.4、6.4、3.7。
请回答下列问题:
(1)本实验最适合的氧化剂X是__________。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)加入氧化剂的目的是__________________________________________。
(3) 物质Y不可以是 ___________;
A.CuO B.CuCl2 C.Cu(OH)2 D.CuCO3
加入Y可以达到实验目的的理由是 .
(4)最后能不能直接蒸发结晶得到CuCl2? ______(填“能”或“不能”)。
如不能,应如何操作?(如能,此空不填)_________________________________________。
查看答案和解析>>
科目: 来源: 题型:
(15分)若用浓度为0.2mol·L-1的标准盐酸滴定一未知浓度的氢氧化钠溶液(一、二两次滴定),再用此氢氧化钠溶液滴定另一未知浓度的盐酸(三、四两次滴定),滴定时纪录了以下4组数据:
| 滴定次数 | 待测碱(酸)溶液体积V/mL | 标准酸(碱)溶液 | ||
| 滴定前刻度 | 滴定后刻度 | 消耗体积/mL | ||
| 第一次 | 10.0(NaOH) | 0 | 10.42 | |
| 第二次 | 10.0(NaOH) | 12.20 | 22.78 | |
| 第三次 | 10.0(HCl) | 0 | 11.42 | |
| 第四次 | 10.0(HCl) | 11.10 | 22.54 | |
(1)由以上数据可算出待测碱液浓度为 mol·L-1,待测酸液浓度为 mol·L-((2)在三、四两次滴定中,应选用 作指示剂,达滴定终点的现象是
.
(3)若在滴定实验过程中存在下列操作,其中会使待测液的浓度偏小的是 .
A.锥形瓶水洗之后未用待测液润洗
B.滴定前尖嘴部分有一气泡,滴定终点时消失
C.装标准液的滴定管未用标准液润洗
D.滴定前仰视读数,滴定后俯视读数
查看答案和解析>>
科目: 来源: 题型:
(15分)(1)在某温度下,H2O的离子积常数为1×10-13,则在该温度下
①0.01mol/LNaOH溶液的pH= 。
②100mL 0.1mol/L H2SO4溶液与100mL 0.4mol/L的KOH溶液混合后,pH=
(2)pH值相同的 ①HCl(aq)、 ②H2SO4(aq)、 ③ CH3COOH(aq)各100 mL
①三种溶液中物质的量浓度最大的是 。
②分别用0.1 mol/L的NaOH(aq)中和,其中消耗NaOH(aq)最多的是 。
(3)相同条件下,测得① NaHCO3(aq)② CH3COONa(aq)③ NaClO(aq)三种稀溶液pH值相同。那么,它们的物质的量浓度由大到小的顺序是 。
查看答案和解析>>
科目: 来源: 题型:
(14分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表: www.ks5.u.com
www.ks5.u.com
| 实验编号 | HA物质的量 浓度(mol·L-1) | NaOH物质的量 浓度(mol·L-1) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | C1 | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
请回答:
(1)不考虑其它组的实验结果,单从甲组情况分析,
若a 7(填>、<或=),则HA为强酸;
若a 7(填>、<或=),则HA为弱酸。
(2)在乙组中混合溶液中离子浓度(A-)与(Na+)的大小关系是 。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HA是 酸(选填“强”或“弱”)。
该混合溶液中离子浓度由大到小的顺序是
。
(4)丁组实验所得混合溶液中由水电离出的c(H+)= mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
用0.1mol/L盐酸分别与25mlNaOH溶液和25ml氨水完全反应,都消耗了25ml盐酸,这表明NaOH溶液和氨水的关系是
A.PH相同 B.物质的量浓度相同
C.电离平衡常数相同 D.反应后所得溶液的PH相同
查看答案和解析>>
科目: 来源: 题型:
(共17分)(传统的定量化学实验受到计量手段的制约而研究范围狭窄、精确度不高。随着DIS系统(即数字化信息系统,由传感器、数据采集器和计算机组成)的发明和使用,这一问题有了很大程度的改善。某学习小组利用中和反应原理和DIS系统测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点。实验步骤如下:
⑴用 (填仪器名称)量取10.00mL氨水样品,在 (填仪器名称)中用一定量蒸馏水稀释并 后转移(含洗涤液)到
100mL (填仪器名称)中,用 (填仪器名称)加蒸馏水定容、混匀后,将所得溶液装入试剂瓶备用。
 ⑵量取20.00mL上述溶液倒入洁净干燥锥形瓶中,连接好DIS系统。
⑵量取20.00mL上述溶液倒入洁净干燥锥形瓶中,连接好DIS系统。
如果锥形瓶中含有少量蒸馏水,是否会影响测量结果 (填“是”、“否”、“不能确定”),
⑶向锥形瓶中滴加0.1000mol/L的盐酸,计算机屏幕上显 示出溶液导电能力与加入盐酸体积关系的曲线图
(见右)。
①滴定管盛放盐酸前,要先 ,
再 用少量蒸馏水 ,
再用 ,然后才 能盛放盐酸。滴定管中加入盐酸、排净 后,凹液面的最低点应处于滴定管的 。
②氨水与盐酸反应的离子方程式为 。
③简述判断滴定中点的理由 。
④该氨水样品的物质的量浓度为 。
查看答案和解析>>
科目: 来源: 题型:
(共8分)(1)在某温度下,H2O的离子积常数为1×10-13,则在该温度下
①0.01mol/LNaOH溶液的pH= 。
②100mL 0.1mol/L H2SO4溶液与100mL 0.4mol/L的KOH溶液混合后,pH=
(2)pH值相同的 ①HCl(aq)、 ②H2SO4(aq)、 ③ CH3COOH(aq)各100 mL
①三种溶液中物质的量浓度最大的是 。
②分别用0.1 mol/L的NaOH(aq)中和,其中消耗NaOH(aq)最多的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com