
科目: 来源: 题型:
(12分)已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(杂质与酸不反应)。某化学兴趣小组在实验室条件下以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。
步骤一:电解精制:
电解时,粗铜应与电源的 ▲ 极相连,阴极上的电极反应式为 ▲ 。
电解过程中,硫酸铜的浓度会 ▲ (选填:变大、不变、变小)。
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:
 |
(1)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,该步反应的离子方程式为 ▲ 。残渣含有极少量的黄金。为了回收金,他们查阅了有关资料(见下表):
| 序号 | 反应 | 化学平衡常数 |
| 1 | Au + 6HNO3(浓) | << 1 |
| 2 | Au3+ + 4Cl- = AuCl4- | >>1 |
从资料中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1∶3的混合物),请你从化学平衡移动的角度简要解释金能够溶于王水的原因 ▲ 。
 (2)滤液含量的测定:以下是该小组探究滤液的一个实验流程:
(2)滤液含量的测定:以下是该小组探究滤液的一个实验流程:
则100mL滤液中Cu2+ 的浓度为 ▲ mol·L-1 ,Fe2+的浓度为 ▲ mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
(10分)重铬酸钠(Na2Cr2O7)广泛用作氧化剂、鞣革剂等。以铬矿石(主要成分为
Cr203,还含有FeO、A1203、Si02等杂质)为原料制取重铬酸钠的流程如下:
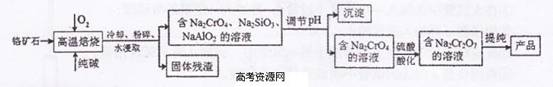
 请回答下列问题:
请回答下列问题:
(1)Cr203在高温焙烧时反应的化学方程式为 。
(2)生产过程中,调节(含Na2Cr04、Na2Si03、NaAl02
的溶液)pH的目的是 。
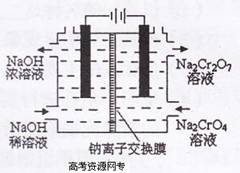
(3)某化工厂采用石墨作电极电解Na2Cr04溶液,实现了
Na2Cr04转化为Na2Cr207的生产,其原理如右图所示。
①写出阳极的电极方程式: ;
②此生产方法和上述流程相比的优点主要有 。
(4)Na2Cr207可用于测定废水的化学耗氧量(即COD,指每升水样中还原性物质被
氧化所需要的02的质量)。现有某水样100.00 mL,酸化后加入cl mol/L。的
Na2Cr207溶液![]() mL,使水中的还原性物质完全被氧化(还原产物为
mL,使水中的还原性物质完全被氧化(还原产物为![]() );再用
);再用
![]()
![]() 的FeS04溶液滴定剩余的
的FeS04溶液滴定剩余的![]() ,结果消耗FeS04溶液
,结果消耗FeS04溶液![]() mL。则该水
mL。则该水
样的COD为 ![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
某同学按右图所
示的装置进行试验。A、B 为两种常见金属,它们的硫酸盐可溶于水。当 K 闭合时,在交换膜处 SO42一从右向左移动。下列分析错误的是
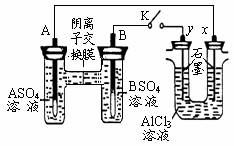 A.金属活动性A强于B
A.金属活动性A强于B
B.B 的电极反应:B-2e一= B2+
C.x电极上有 H2 产生,发生还原反应
D.反应初期,x 电极周围出现白色沉淀
查看答案和解析>>
科目: 来源: 题型:
著名化学家徐光宪获得2008年度“国家最高科学技术奖”,以表彰他在稀土串级萃取理论方面作出的贡献。稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是
A.电解熔融Ce02制Ce,铈在阳极获得
B.铈溶于氢碘酸的化学方程式可表示为:Ce+4HI=CeI4+2H2↑
C.用Ce(S04)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+=Ce3++2Fe3+
D.四种稳定的核素13658Ce、13858Ce、14058Ce、14258Ce,它们互称为同位素
查看答案和解析>>
科目: 来源: 题型:
设NA表示阿伏加德罗常数的值,下列有关NA的叙述中正确的有
①0.25molNa2O2中含有的阴离子数为0.5NA
②7.5gSiO2晶体中含有的硅氧键数为0.5NA
③1 mol α-氨基乙酸(甘氨酸)分子中存在10 NA对共用电子
④250mL2mol/L的氨水中含有NH3·H2O的分子数为0.5NA
⑤3.0 g淀粉和葡萄糖混合物中共含碳原子数为0.1NA
⑥18g D2O(重水)完全电解,转移NA个电子
⑦标准状况下,2.24L CHCl3含有的分子数为0.1NA
⑧电解精炼铜时,当阳极溶解32 g铜时,转移的电子数为NA个
A.2个 B.3个 C.4个 D.5个
查看答案和解析>>
科目: 来源: 题型:
(8分)利用天然气合成氨的工艺流程示意图如下:
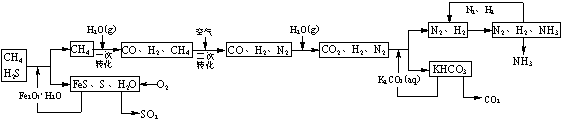
依据上述流程,完成下列填空:
⑴图中CH4的一次转化过程中的化学方程式是 。
⑵脱硫过程中,若有n mol Fe2O3·H2O转化,则反应掉H2S物质的量为 mol(用含n的代数式表示)。
⑶整个流程有三个循环:一是K2CO3(aq)循环,二是N2和H2循环,第三个循环中被循环物质是 。
⑷改用过量NaOH溶液吸收天然气中的硫化氢,以石墨作电极电解吸收后所得溶液可回收得到硫,同时得到副产物H2。其电解总反应方程式(忽略氧气的氧化还原)为 。
查看答案和解析>>
科目: 来源: 题型:
设NA表示阿伏加德罗常数,下列叙述正确的是
A.71 g氯气被还原得到的电子数为2NA
B.100 mL l mol·L-1的碳酸钠溶液中含有的CO32-数为0.1NA
C.标准状况下,2.24 L乙烯中含有的σ键数目为0.5 NA
D.用含有少量锌、铁、银等杂质的粗铜作阳极电解精炼,当阴极析出64 g金属时阳极失去的电子数小于2NA[来源:高&考%资(源#网.COM]
查看答案和解析>>
科目: 来源: 题型:
(10分)钨是高熔点金属,工业上用黑钨铁矿[(Fe,Mn)WO4]冶炼金属钨有多种方法,同时还可制得副产品高锰酸钾。已知WO3是钨的稳定氧化物,它不溶于水也不溶于酸,可用钨酸(H2WO4,黄色,不溶于水)或某些钨酸盐分解制得。其主要的工艺流程如下:

请根据图示及所学知识回答下列问题:
⑴写出反应④的化学方程式: 。
⑵写出反应⑨的离子方程式: 。
⑶方法二制WO3的过程中,需洗涤CaWO4,如何检验CaWO4已洗涤干净: 。
⑷整个工艺流程所涉及的物质中,属于酸性氧化物的有 。
⑸写出反应⑩中阳极反应的电极反应式: 。
查看答案和解析>>
科目: 来源: 题型:
阿伏加德罗常数约为6.02×1023mol-1。下列叙述中正确的是
A.电解精炼铜的过程中,每转移6.02×1023个电子时,阳极溶解铜的质量为32g
B.在标准状况下,2.24L己烷中所含分子数为6.02×1023
C.12.5 mL 16 mol/L浓硫酸与足量铜反应,生成SO2的分子数为6.02×1022
D.1molCl2与1molCH4恰好完全反应,则转移的电子总数为2NA
查看答案和解析>>
科目: 来源: 题型:
(8分)如图所示,若电解5min时铜电极质量增加2.16g,试回答:
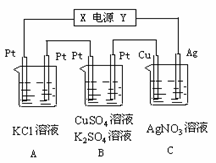 ⑴ 电源电极X名称为____________。
⑴ 电源电极X名称为____________。
⑵ pH变化:A池_______,B池______,C池_______。
⑶ 通过5min时,B中共收集224mL气体(标况),溶液体积为
200mL,则通电前硫酸铜溶液的物质的量浓度为___________。
⑷ 若A中KCl溶液的体积也是200mL,电解后溶液的pH = _ __。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com