
科目: 来源: 题型:
下列文字表述与离子方程式对应且正确的是
A.用石墨作电极电解NaCl溶液:2C1-+2H2O电解====C12↑+2OH-+H2↑学科
B.硫氢化钠的水解:HS-+H2O![]() H3O++S2-科网
H3O++S2-科网
C.硫化钠的水解:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
D.碳酸氢钠与氢氧化钠溶液的反应:HCO3-+OH-=CO32-+H2O
查看答案和解析>>
科目: 来源: 题型:
下列有关工业生产的叙述正确的是
A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.硫酸工业中,在接触室安装热交换器是为了利用SO2转化为SO3时放出的热量
C.电解饱和食盐水制烧碱采用阳离子交换膜法,可防止阴极室产生的C12进入阳极室
D.电解精炼铜时,同一时间内阳极溶解铜的质量与阴极析出铜的质量相等
查看答案和解析>>
科目: 来源: 题型:
(10分)FeCl3可作印刷电路铜板腐蚀剂,反应的方程式为 2FeCl3+Cu=2FeCl2+CuCl2。
(1)将上述反应设计成的原电池如下左图所示,请回答下列问题:
①电极X的材料是 ;电解质溶液Y是 。
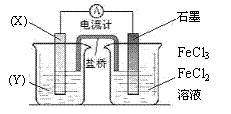 |  | ||
(2)腐蚀铜板后的废腐蚀液中,含有FeCl3、FeCl2、CuCl2等物质,用电解法可回收铜且得到FeCl3溶液,其工作原理如上右图所示。请回答下列问题:
①该电解槽阴极的反应式是 、 。
②阴离子交换膜中通过的离子主要是 ,FeCl3溶液从出口 (填写 “A”或“B”)导出。
查看答案和解析>>
科目: 来源: 题型:
PH = a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的PH>a,则该电解质可能是 ( )
A.NaOH B.H2SO4 C.K2CO3 D.Na2SO4
查看答案和解析>>
科目: 来源: 题型:
下列反应的离子方程式正确的是 ( )
A.NaHCO3溶液中加入盐酸:CO32-+ 2H+ = CO2↑+ H2O
![]() B.紫色石蕊试液中滴入氢硫酸变红的原因是:H2S 2H+ + S2-
B.紫色石蕊试液中滴入氢硫酸变红的原因是:H2S 2H+ + S2-
C.将NaHSO4溶液滴入Ba(OH)2溶液中至pH=7
![]() 2H+ + SO42-+ 2OH-+ Ba2+ = BaSO4↓+ 2H2O
2H+ + SO42-+ 2OH-+ Ba2+ = BaSO4↓+ 2H2O
D.惰性电极电解CuSO4溶液:Cu2+ + 2H2O Cu + O2↑+ 4H+
查看答案和解析>>
科目: 来源: 题型:
(8分)
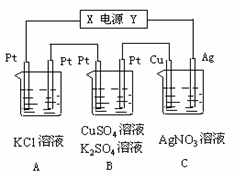 如图所示,若电解5min时铜电极质量增加2.16g,B池的两极都有气体产生。
如图所示,若电解5min时铜电极质量增加2.16g,B池的两极都有气体产生。
试回答:
⑴ 电源电极X名称为__(填“正极”或“负极”)
⑵ 各烧杯中溶液的 pH变化:(填“增大”、
“减小”或“不变”)
A池________________,B池________________,C池________________。
⑶ 写出B池中所发生的电解反应方程式:
___________________________________、_____________________________________。
查看答案和解析>>
科目: 来源: 题型:
下列实验现象描述正确的是
A.向胆矾晶体中加入一定量的浓硫酸,搅拌,可观察到晶体由蓝色变为白色
B.铁丝在氯气中燃烧,火星四射,并产生耀眼的光芒
C.新制的氯水滴到蓝色的石蕊试纸上,只能看到试纸变红
D.电解饱和食盐水后的溶液滴入酚酞试液变红
查看答案和解析>>
科目: 来源: 题型:
用酸性氢氧燃料电池电解苦卤水 (含Cl-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极)。下列说法中,正确的是
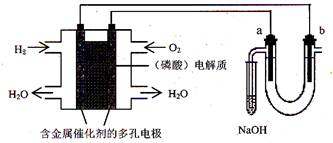
A.电池工作时,正极反应式为:O2 +2 H2O + 4e-= 4OH-
B.忽略能量损耗,当电池中消耗0.02g H2 时,a 极周围会产生0.02g H2
C.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
D.电解时,a 电极周围首先放电的是Br-而不是Cl-,说明当其它条件相同时Br-的还原性强于Cl-
查看答案和解析>>
科目: 来源: 题型:
(10分)工业含铬(Cr)废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为沉淀。废水pH与Cr2O72-转化为Cr3+的关系如图1,实验室模拟工业电解法处理含铬废水的装置如图2:

请根据以上知识回答下列问题:
⑴ 含铬废水预处理的方法是 。
⑵ 在图2中连接铁棒的一极是电源的 极。
⑶ 实验中除能观察到废水颜色发生变化外,还能观察到的现象是 。
表一:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cr(OH)3 | Al(OH)3 |
| 开始沉淀 | 2.7 | 7,5 | 4.3 | 3.4 |
| 完全沉淀 | 4.1 | 9.7 | 5.6 | 5.2 |
⑷ 当废水颜色不再发生明显变化时,切断电源,取出电极,再调节电解液的pH至8左右。调节pH的目的是 。
⑸ 含铬废水国家排放标准为![]() 含量≤0.1000mg/L。取上述电解后的废水200.00mL,调节pH=1后置于锥形瓶中,用浓度为0.0001mol/L的KI溶液滴定,至滴定终点时,用去KI溶液9.00mL。已知酸性条件下,I-被Cr2O72-氧化的产物为I2。用计算所得数据说明上述电解法处理后的废水是否符合国家排放标准 。
含量≤0.1000mg/L。取上述电解后的废水200.00mL,调节pH=1后置于锥形瓶中,用浓度为0.0001mol/L的KI溶液滴定,至滴定终点时,用去KI溶液9.00mL。已知酸性条件下,I-被Cr2O72-氧化的产物为I2。用计算所得数据说明上述电解法处理后的废水是否符合国家排放标准 。
查看答案和解析>>
科目: 来源: 题型:
(9分)某地有软锰矿和闪锌矿两座矿山,它们的组成如下:软锰矿:MnO2含量≥65%, SiO2含量约20%,Al2O3含量约4%,其余为水分;闪锌矿:ZnS含量≥80%,FeS、CuS、SiO2含量约7%,其余为水分。科研人员开发了综合利用这两种资源的同槽酸浸工艺,工艺流程如下图所示。
|
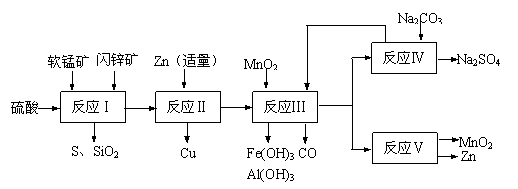
请回答下列问题:
(1)反应Ⅰ后过滤所得滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等。试写出反应Ⅰ中生成CuSO4的化学方程式 ▲ 。
(2)反应Ⅱ加入适量锌的作用是 ▲ 。如果锌过量,还会进一步发生反应的离子方程式为 ▲ 。
(3)反应Ⅴ的条件是电解,电解时均用惰性电极,阳极发生的电极反应可表示为 ▲ 。
(4)本工艺所用的原料除软锰矿、闪锌矿、硫酸外还需要的原料是 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com