
科目: 来源: 题型:
(10分)图表法、图象法是常用的科学研究方法,根据下图回答问题:

I.短周期某主族元素M的电离能情况如图(A)所示,则M元素位于周期表的第______族。
![]() II.图B是研究部分元素的氢化物沸点变化规律的图像,折线c可以表达出第_______族元素氢化物的沸点的变化规律。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线——折线a和折线b,你认为正确的是:______。
II.图B是研究部分元素的氢化物沸点变化规律的图像,折线c可以表达出第_______族元素氢化物的沸点的变化规律。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线——折线a和折线b,你认为正确的是:______。
III.人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属则被科学家预测为是钛(Ti)。钛被誉为“未来世纪的金属”。试回答下列问题:
 (1) 22Ti元素基态原子价电子的轨道表示式为_______________。
(1) 22Ti元素基态原子价电子的轨道表示式为_______________。
(2) Ti在化合物中,可以呈现+2、+3、+4三种化合价,其中
以+4价的Ti最为稳定。偏钛酸钡的热稳定性好,介电常数
高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶
体中晶胞的结构示意图如右图,则它的化学式是__________。
查看答案和解析>>
科目: 来源: 题型:
![]() (12分)(1)一种Al-Fe合金的立体晶胞如图1所示,该晶胞中有________个Fe原子,________个Al原子,Fe原子的堆积方式为_______________,每个Fe原子周围距离最近且相等的Fe原子有_______个。该合金的化学式为_________。用NA表示阿伏加德罗常数,晶胞的边长=a cm,则此合金的密度为________________g/cm3。
(12分)(1)一种Al-Fe合金的立体晶胞如图1所示,该晶胞中有________个Fe原子,________个Al原子,Fe原子的堆积方式为_______________,每个Fe原子周围距离最近且相等的Fe原子有_______个。该合金的化学式为_________。用NA表示阿伏加德罗常数,晶胞的边长=a cm,则此合金的密度为________________g/cm3。
(2)石墨的层状结构如图2所示,图中7个六元环实际占有的碳原子数是 ,若该层状结构可由很多个平行四边形无隙并置得到,每个平行四边形实际占有2个碳原子,请在图中画出一个这样的平行四边形。


查看答案和解析>>
科目: 来源: 题型:
下列各ww w.ks 5u.c om组物质熔化或升华时,所克服的粒子间作用力属于同种类型的是
A.Na2O和SiO2熔化 B.Mg和S熔化
C.碘和干冰升华 D.氯化钠和蔗糖熔化
查看答案和解析>>
科目: 来源: 题型:
(12分)(1)图A是某短周期元素M的部分电离能变化情况。M元素位于周期表的第 族。
 (2)图B是部分同主族元素氢化物沸点的变化规律图像。两位同学对某主族元素氢化物沸点的变化趋势画出了两条折线a和b,正确的是 (填“a”或“b”),理由 。
(2)图B是部分同主族元素氢化物沸点的变化规律图像。两位同学对某主族元素氢化物沸点的变化趋势画出了两条折线a和b,正确的是 (填“a”或“b”),理由 。
A B
(3)甲、乙两种氢化物分子中,中心原子的轨道杂化方式相同,但甲、乙两分子的立体结构不同,原因是 。


 (4)下图是常见金属晶体的四种堆积模型:
(4)下图是常见金属晶体的四种堆积模型:

A B C D
(简单立方) (体心立方) (ABAB型) (ABCABC型)
请判断下列四种金属晶体分别对应的堆积模型:(填序号)
Po K Mg Cu
查看答案和解析>>
科目: 来源: 题型:
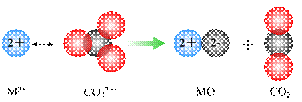
(10分)由氧化物经氯化作用生成氯化物是工业生产氯化物的常用方法,Cl2、CCl4是常用的氯化剂。如:
 Na2O+Cl2=2NaCl+O2
Na2O+Cl2=2NaCl+O2
CaO+Cl2=CaCl2+O2
SiO2+2CCl4=SiCl4+2COCl2
Cr2O3+3CCl4=2CrCl3+3COCl2
请回答下列问题:
⑴ Cr2O3、CrCl3中Cr均为+3价,写出Cr3+的基态电子排布式 ;
⑵ CCl4分子中C原子采取 杂化成键。
⑶ COCl2俗称光气,分子中C原子采取sp2杂化成键。光气分子的结构式是 ,其中碳氧原子之间共价键是 (填序号):
a.2个σ键 b.2个π键 c.1个σ键、1个π键
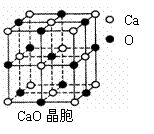
⑷ CaO晶胞如右上图所示,CaO晶体中Ca2+的配位数为 。CaO晶体和NaCl晶体中离子排列方式相同,其晶格能分别为:CaO-3 401kJ•mol-1、NaCl-786kJ•mol-1。导致两者晶格能差异的主要原因是 。
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是
A.含有阴离子的晶体中必含有阳离子
B.由极性键构成的AB2型分子必是极性分子
C.非金属元素组成的化合物中只含有共价键
D.离子晶体中必含有离子健,分子晶体中必含有共价键
查看答案和解析>>
科目: 来源: 题型:
晶胞是晶体结构中可重复出现的最小的结构单元,C60晶胞结构如右
 图所示(一个小黑点代表一个C60分子),下列说法正确的是
图所示(一个小黑点代表一个C60分子),下列说法正确的是
A.C60摩尔质量是720
B.C60与金刚石都是碳元素形成的单质分子
C.在C60晶胞中有14个C60分子
D.每个C60分子周围与它距离最近等距离的C60分子有12个
查看答案和解析>>
科目: 来源: 题型:
(14分)有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度是同族元素所形成的氢化物中最大的;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A与D离子数之比为2∶1。请回答下列问题:
⑴A单质、B单质、化合物R的熔点大小顺序为下列的 (填序号):
①A单质>B单质>R; ②R>A单质>B单质;
③B单质>R >A单质; ④A单质>R>B单质。
 ⑵在CB3分子中C元素原子的原子轨道发生的是________杂化,其固体的晶体类型为 ;
⑵在CB3分子中C元素原子的原子轨道发生的是________杂化,其固体的晶体类型为 ;
⑶写出D原子的核外价电子排布式 _,C的氢化物比D的氢化物在水中溶解度大得多的可能原因
;
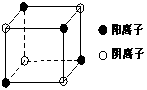
⑷右图是D和Fe形成的晶体FeD2最小单元“晶胞”,FeD2晶体
中阴、阳离子数之比为 ,FeD2物质中具有的化
学键类型为 。
查看答案和解析>>
科目: 来源: 题型:
(12分)为比较温室效应气体对全球增温现象的影响,科学家以CO2为相对标准,引入了“温室效应指数”的概念(如下表)。
| 物质 | 大气中的含量 (体积百分比) | 温室效应 指数 |
| CO2 | 0.03 | 1 |
| H2O | 1 | 0.1 |
| CH4 | 2×10-4 | 30 |
| N2O4 | 3×10-5 | 160 |
| O3 | 4×10-6 | 2000 |
| CCl2F2 | 4.8×10-8 | 25000 |
回答下列问题:
⑴6种气体中,温室效应指数最大的物质属于 ▲ (选填“极性分子”或“非极性分子”)。
⑵在水分子中,O原子上的价层电子对数为 ▲ 。
⑶N2O4分子结构式为![]() ,分子为平面结构。N2O4分子中N原子的杂化方式为 ▲ ,在N2O4分子的结构式上,将你认为是配位键的共价键上加上箭头 ▲ 。
,分子为平面结构。N2O4分子中N原子的杂化方式为 ▲ ,在N2O4分子的结构式上,将你认为是配位键的共价键上加上箭头 ▲ 。
⑷O3具有吸收紫外光的功能。
①根据等电子原理,判断O3分子的空间构型为 ▲ 。
②紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因: ▲ 。
| 共价键 | C-C | C-N | C-S |
| 键能/ kJ·mol-1 | 347 | 305 | 259 |
查看答案和解析>>
科目: 来源: 题型:
(12分)一般地,晶体类型不同,其结构和性质也不同。
⑴下表是四种同主族元素的氧化物的离子晶体晶格能数据。
| 氧化物 | MgO | CaO | SrO | BaO |
| 晶格能/ kJ·mol-1 | 3791 | 3410 | 3223 | 3054 |
①将上表中四种氧化物的共熔物冷却,首先析出的是 ▲ 。
②碳酸盐的热分解示意图如下图。两种碳酸盐的热分解温度CaCO3 ▲ SrCO3(填“高于”或“低于”)
 ⑵已知NH3·H2O的电离方程式为NH3·H2O
⑵已知NH3·H2O的电离方程式为NH3·H2O![]() NH4++OH-,当氨水冷却时,可以将NH3·H2O和2NH3·H2O等晶体沉淀出来。
NH4++OH-,当氨水冷却时,可以将NH3·H2O和2NH3·H2O等晶体沉淀出来。
①2NH3·H2O的晶体类型为 ▲ 。
②NH3极易溶于水,其主要原因是 ▲ 。
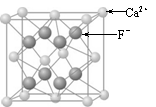
⑶CaF2的晶体结构如右图所示。
①CaF2晶体中钙离子的配位数是 ▲ 。
②一个CaF2晶胞中包含 ▲ 个钙离子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com