
科目: 来源: 题型:
下列说法中正确的是
①活化分子间的碰撞一定能发生化学反应 ②普通分子间的碰撞有时也能发生化学反应
③活化分子比普通分子具有较高的能量 ④化学反应的实质是原子的重新组合
⑤化学反应的实质是旧化学键的断裂和新化学键的形成过程
⑥化学反应的实质是活化分子有合适取向时的有效碰撞
A.①③④⑤ B.②③⑥ C.③④⑤⑥ D.②④⑤
【解析】只有能引起化学反应的碰撞才是有效碰撞,而只有活化分子才也可能发生有效碰撞,有效碰撞是发生化学反应的充要条件,所以①②是错误的,答案选C。
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是
A.同温同压下,H2(g)+Cl2(g)==2HCl(g)在光照和点燃条件下的△H相同
B.铅蓄电池放电时的负极和充电时的阴极均发生还原反应
C.已知:H2(g) + I2(g)2HI(g);△H =-9.48 kJ/mol,若将254g I2(g)和2gH2(g)充分反应可放出9.48 kJ的热量
D.已知在101 kPa时,2 g碳燃烧生成CO放出热量为Q kJ,则碳的燃烧热为6Q kJ·mol-1
【解析】反应热与反应条件无关,A正确。铅蓄电池放电时的正极和充电时的阴极均发生还原反应,B错误。选项C中是可逆反应,所以254g I2(g)和2gH2(g)充分反应放出的热量小于9.48 kJ,C不正确。燃烧热是指在一定条件下,1mol物质完全燃烧生成稳定的氧化物时所放出的能量,因此D不正确。答案是A。
查看答案和解析>>
科目: 来源: 题型:
下列各组实验装置能达到实验目的的是
A.用图1所示装置组成锌铜原电池
B.用图2所示装置在铁棒上镀锌
C.用图3所示装置测定稀硫酸和稀NaOH反应的中和热
D.用图4所示装置研究温度对2NO2(g)![]() N2O4(g)平衡的影响
N2O4(g)平衡的影响
【解析】若用盐桥来连接,则锌电极要插入硫酸锌中,铜电极要插入硫酸铜中,A不正确。铁上镀锌时,铁应该与电源的负极相连,锌与电源的正极相连,B不正确。图③中缺少环形玻璃搅拌棒,不正确,所以正确的答案是D。
查看答案和解析>>
科目: 来源: 题型:
一定条件下,下列不能用勒夏特列原理解释的是
A.工业生产硫酸的过程中使用适当过量氧气,以提高SO2的转化率
B.氢气、碘蒸气、碘化氢气体组成的平衡体系加压后气体颜色变深
C.实验室用排饱和NaHCO3溶液的方法收集CO2气体
D.新制氯水中,滴加硝酸银溶液,溶液颜色变浅,产生白色沉淀
【解析】A中增大氧气的浓度,平衡向正反应方向移动,提高SO2的转化率。氢气和碘蒸汽生成碘化氢的反应是体积不变的可逆反应,增大压强,浓度变大,颜色加深,但平衡不移动,不能用勒夏特列原理解释。C属于溶解平衡,正确。D属于沉淀溶解平衡,正确,所以答案是B。
查看答案和解析>>
科目: 来源: 题型:
高温下,某反应达到平衡,平衡常数K=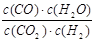 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是
A.该反应是焓变为正值 B.该反应化学方程式为CO+H2OCO2+H2
C.升高温度,逆反应速率减小 D.恒温下,缩小容器体积,H2浓度一定减小
【解析】根据平衡常数的表达式可以得出反应的方程式CO2+H2CO+H2O,温度升高,氢气浓度减小,则平衡向正反应方向移动,所以反应是吸热反应,A正确。只要温度升高,反应速率就一定增大,反应前后体积不变,所以缩小容器容积,平衡不移动,但氢气浓度会增大,所以答案是A。
查看答案和解析>>
科目: 来源: 题型:
某研究组设想以如图所示装置用电化学原理生产硫酸。关于该装置的叙述正确的是
A.该装置为原电池,通入O2的电极是负极
B.该装置中,通入SO2的电极的电极反应式为:SO2+O2-+H2O -2e-=2H++SO42-
C.该装置中,H+通过质子膜向左侧移动
D.在标准状况下,理论上每消耗11.2L SO2,则可产生0.5mol H2SO4
【解析】氧气是得电子得,所以氧气在正极通入。SO2在反应中失去电子,在负极通入,所失去得电子经导线传递到正极上,所以溶液中得阳离子向正极移动。因为交换膜只允许氢离子通过,所以负极得电极反应式为SO2+2H2O -2e-=4H++SO42-。所以正确的答案是D。
查看答案和解析>>
科目: 来源: 题型:
对于可逆反应N2(g)+3H2(g)2NH3(g);△H<0,下列研究目的和示意图相符的是
|
| A | B | C | D |
| 研究目的 | 压强对反应的 影响(P2>P1) | 温度对反应的影响 | 增加N2的浓度对反应的影响 | 催化剂对反应的 影响 |
| 图示 | | | | |
【解析】氨气的合成是体积减小的放热的可逆反应,压强越大,反应速率越大,到达平衡的时间就越少,A不正确。升高温度,平衡向逆反应方向移动,所以氮气的转化率降低,B不正确。增大氮气浓度,平衡向向正反应方向移动,C正确。催化剂能加快反应速率,缩短到达平衡的时间,D不正确。答案是C。
查看答案和解析>>
科目: 来源: 题型:
对苯二酚是摄影业中常用显影剂,它在水中电离出的阴离子对已曝光的AgBr有显影作用,有关变化可表示为:
则在以对苯二酚为主要成分的显影液中,能使显影速度明显加快的添加剂是
A.KBr B.Na2CO3 C.CH3COOH D.H2O
【解析】要使显影速度明显加快,则平衡必须向正反应方向移动碳酸钠能消耗氢离子,促使对苯二酚的电离向正反应方向移动,所以答案是B。
查看答案和解析>>
科目: 来源: 题型:
将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是
A.做该实验时环境温度为22 ℃
B.该实验表明化学能可以转化为电能
C.NaOH溶液的浓度约是1.5mol/L
D.该实验表明有水生成的反应都是放热反应
【解析】温度为22℃对应的盐酸的体积是5ml,即该温度是反应后溶液的温度,因此环境温度一定低于22℃.只有当二者恰好反应时放出的热量才最多,溶液的温度才最高,根据图像可判断当盐酸的体积是30ml时温度最高,所以氢氧化钠的浓度是![]() ,该实验验证的是化学能和热能的转化,B不正确。选项D也不一定正确,所以正确的答案是C。
,该实验验证的是化学能和热能的转化,B不正确。选项D也不一定正确,所以正确的答案是C。
查看答案和解析>>
科目: 来源: 题型:
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:
2 SO2(g)+O2 (g)2SO3(g) △H=-196.4 kJ/mol。
实验测得起始、平衡时的有关数据如下表:
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| SO2 | O2 | SO3 | ||
| ① | 2 | 1 | 0 | 放出热量a kJ |
| ② | 1 | 0.5 | 1 | 放出热量b kJ |
| ③ | 4 | 2 | 0 | 放出热量c kJ |
下列叙述正确的是
A.放出热量关系:a = b B.三个容器内反应的平衡常数:③>②>①
C.平衡时SO3气体的体积分数:③>① D.SO2的转化率:②>①>③
【解析】平衡的建立和途径无关,所以②中相当于是2molSO2和1molO2,即①②中的平衡是等效的。但在反应过程中实际消耗的氧气是不相同的,所以a不等于b。温度相同,平衡常数就相同,B不正确。③相当于增大压强,平衡向正反应方向移动,所以SO2的转化率增大,SO3的体积分数也增大。因此正确的答案是C。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com