
科目: 来源: 题型:
已知在热的碱性溶液中,NaClO发生如下反应:3NaClO![]() 2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,其最终产物是
2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,其最终产物是
A.NaCl、NaClO B.NaCl、NaClO3
C.NaClO、NaClO3 D.NaClO3、NaClO4
查看答案和解析>>
科目: 来源: 题型:
(NH4)2SO4在高温下分解,产物是SO2、H2O、N2和NH3。在该反应的化学方程式中,化学计量数由小到大的产物分子依次是
A.SO2、H2O、N2、NH3 B.N2、SO2、H2O、NH3
C.N2、SO2、NH3、H2O D.H2O、NH3、SO2、N2
查看答案和解析>>
科目: 来源: 题型:
纳米材料的表面粒子数占总粒子数的比例极大,这是它具有许多特殊性质的原因。假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状相同。则这种纳米颗粒的表面粒子数占总粒子数的百分数为
A.87.5% B.92.9% C.96.3% D.100%
查看答案和解析>>
科目: 来源: 题型:
(13分) 实验室用氯化钠固体配制1![]() 的NaCl溶液0.5L,回答下列问题:
的NaCl溶液0.5L,回答下列问题:
(1)请写出该实验的实验步骤:
①计算,② ,③ ,④ ,⑤洗涤,⑥ ,⑦摇匀。
用托盘天平(指针向上的)称量样品时,若指针偏向右边,则表示( )
A、左盘重,样品轻 B、左盘轻,砝码重
C、右盘重,砝码轻 D、右盘轻,砝码重
需要NaCl g,实际用托盘天平称量的质量是 g。
(2)所需仪器除托盘天平,还需要哪些玻璃仪器才能完成该实验,请写出: 、 、 、 。
使用容量瓶前必须进行的操作是 。
(3)从该溶液中取出50mL,其中NaCl的物质的量浓度为 。
查看答案和解析>>
科目: 来源: 题型:
(8分)在2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X、Y为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 molXY2含有54 mol电子。
(1)该融雪剂的化学式是 ;X与氢元素形成的化合物的是 。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是 ;D与E能形成一种非极性分子,该分子的结构式为 ;D所在族元素的氢化物中,沸点最低的是 。
(3)元素W与Y同周期,其单质是原子晶体;元素Z的单质分子Z2中有3个共价健;W与Z能形成一种新型无机非金属材料,其化学式是 .
(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,R2与NaOH溶液反应的产物之一是OR2,该反应的离子方程式为 。
查看答案和解析>>
科目: 来源: 题型:
(11分)四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数之比为4︰1,其d轨道中的电子数与最外层电子数之比为5︰1。
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,它们的分子
式分别是 、 ;杂化轨道分别是 、 ;a分子的
立体结构是 。
(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是 晶体、
晶体。
(3)X的氧化物与Y的氧化物中,分子极性较小的是(填分子式) 。
(4)Y与Z比较,电负性较大的是 。
(5)W的元素符号是 ,其+2价离子的核外电子排布式是 。
查看答案和解析>>
科目: 来源: 题型:
(11分)某钠盐溶液可能含有阴离子NO3-、CO32-、SO32-、SO42-、Cl-、Br-、I-。为了鉴别这些离子,分别取少量溶液进行以下实验:
①所得溶液呈碱性;
②加HCl后,生成无色无味的气体。该气体能使饱和石灰水变浑浊。
③加CCl4,滴加少量氯水,振荡后,CCl4层未变色。
④加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量的盐酸,沉淀不能完全溶解。
⑤加HNO3酸化后,再加过量的AgNO3,溶液中析出白色沉淀。
(1)分析上述5个实验,写出每一实验鉴定离子的结论与理由。
实验①________________________________________。
实验②_______________________________________。
实验③________________________________________。
实验④________________________________________。
实验⑤________________________________________。
(2)上述5个实验不能确定是否的离子是___________________。
查看答案和解析>>
科目: 来源: 题型:
(5分)德国和美国科学家首先制出由20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成(如右图)。
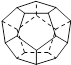
请回答: C20分子共有_______个正五边形,共有_______条棱边,C20晶体属于_______ (填晶体类型).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com