
科目: 来源: 题型:
从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物;④将得到的产物熔融电解得到镁。下列说法不正确的是
A.此法的优点之一是原料来源丰富
B.第④步电解时阴极产生氯气
C.①②③步骤的目的是从海水中提取MgCl2
D.以上提取镁的过程中涉及化合、分解和复分解反应
查看答案和解析>>
科目: 来源: 题型:
.某学习小组拟利用如图装置制备氮化钙(化学式为Ca3N2,极易与水反应)。下
列说法正确的是
A.打开活塞K通入N2,试管A内有气
泡产生,说明装置气密性良好
B.U形管中盛放的干燥剂既可以是碱石
灰,也可以是浓硫酸
C.将产物Ca3N2放入盐酸中,只能得到一种盐
D.反应结束后,先熄灭酒精灯,待反应管冷却后再关闭活塞K
查看答案和解析>>
科目: 来源: 题型:
某混合物的水溶液,只可能含有以下离子中的若干种:K+、![]() 、Cl-、Mg2+、Ba2+、
、Cl-、Mg2+、Ba2+、![]() 、
、![]() ,现取三份100mL溶液进行如下实验:
,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.06mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是
A.K+不可能存在 B.100mL溶液中含0.01mol 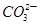
C.可能同时存在K+、Cl- D.Ba2+一定不存在,Mg2+可能存在
查看答案和解析>>
科目: 来源: 题型:
.某化学研究性学习小组对Na2CO3和NaHCO3的混合溶液的组成进行探究。取20.00mL该混合溶液不断加入1.00mol/L的稀盐酸,加入盐酸的体积和产生的现象见下表:
则混合溶液中c(![]() )为
)为
A.0.50mol/L B.1.00mol/L C.1.50mol/L D.2.00mol/L
查看答案和解析>>
科目: 来源: 题型:
(8分)病人输液用的葡萄糖注射液是葡萄糖(C6H12O6)的水溶液,其标签上的部分内容如图所示。利用标签所提供的信息,回答下列问题:
(1)该注射液中葡萄糖的物质的量浓度 ___________________。
(2)配制上述l L溶液所需的仪器有:量筒、烧杯、玻璃
棒、托盘天平、药匙、_____________、______________。(在横线上填写所缺仪器的名称)(3)在1L此溶液的配制过程中,下列操作或说法正确 的是_________________。
A.配制过程中加水时不慎超过了刻度线,把水吸出后再加水刚好至刻度线
B.用托盘天平可以准确称量计算所得葡萄糖的质量
C.用胶头滴管加水时,仰视观察凹液面与容量瓶刻度线相切会导致结果偏低
D.容量瓶使用前未干燥,不会影响实验结果
查看答案和解析>>
科目: 来源: 题型:
(6分)(1)已知拆开1molH-H键,lmolN-H键,1mol![]() 键分别需要的能是436kJ、39lkJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________。
键分别需要的能是436kJ、39lkJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________。
(2)科学家盖斯曾提出:“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的。”利用盖斯定律可测某些特别反应的热效应。已知:
则白磷的稳定性比红磷_____________(填“高”或“低”),理由是________________
__________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
(12分)X、Y、Z、M、N为原子序数小于18的五种元素,X原子的电子层数等于最外层电子数;X与Y处于同一周期,Y与M可形成离子化合物M2Y,该化合物的水溶液显碱性;Z离子核内质子数与核外电子数之和为18;X、Z、M三种元素的离子具有相同的电子层排布;元素N的原子的质子、中子与电子数之和为2。
根据上述信息回答下列问题:
(1)写出质量数为32的Y原子符号____________,M2Y的电子式为________________。
(2)X、Z、M三种元素的离子半径大小顺序为_________________(用离子符号表示)。
(3)下列说法中正确的是___________________________。
A.元素Z与元素M形成的化合物中只有极性共价键和离子键
B.元素M和元素N之间不能形成离子化合物
C.元素X的原子比元素M的原子的失电子能力强
D.元素Z与元素N形成的简单化合物比元素Y与元素N形成的化合物稳定
(4)写出X、M两元素的最高价氧化物对应的水化物反应的离子方程式:
__________________________________________________________________________。
(5)已知(4)反应中生成的含X元素的化合物与HF、NaCl按l :6 :2的物质的量之比恰好完全反应,得到H2O、HCl和另一种含有三种元素且微溶于水的化合物,写出该反应的化学方程式__________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
(14分)某学校研究性学习小组利用实验室常用试剂,
探究硝酸的氧化性。请完成下面的空白:
(1)在具支试管底部滴入5滴浓硝酸,然后用硫化 亚铁与盐酸反应制备H2S气体,如图所示通入具支试管中,可以观察到在试管内形成黄烟,黄烟附着在试管内壁上,形成“黄霜”。
① 出上述制备H2S的离子方程式
______________________________________。
②在试管内壁上的“黄霜”的成分是_______________,该反应说明浓硝酸有氧化性外,实验现象还说明了浓硝酸具有________性。该实验中烧杯内的氢氧化钠溶液的作用是
__________________________________________________________________。
(2)卤族元素单质也具有氧化性,该小组设计了下面的实验探究碘单质与稀硝酸氧化性强弱比较:
①提出合理的假设
假设l:碘单质氧化性强于稀硝酸;假设2:碘单质氧化性弱于稀硝酸。
②设计实验方案,进行实验探究,请写出实验步骤和预期的现象与结论。限选实验试剂与仪器:稀硝酸、KI溶液、四氯化碳;试管、胶头滴管。
查看答案和解析>>
科目: 来源: 题型:
.(12分)在下图转化关系中,固体甲的焰色反应呈黄色,M为常见的液体物质,I为常见金属,且I与G的稀溶液不反应,只能与G的浓溶液在加热条件下反应;酸G是重要的化工产品和化工原料;H为良好的耐火材料(图中部分产物没有列出)。
(1)固体甲的名称为__________,F的化学式为______________。
(2)反应①~⑦中属于氧化还原反应的是______________(填写反应序号)。
(3)工业废气中常含有气体E,为了充分利用资源、保护环境,目前应用最广泛的工业废气处理方法是石灰法。以生石灰为原料在吸收装置中与气体E反应的化学方程式为:
___________________________________________。
(4)反应⑦的化学反应方程式为_____________________________________________。
(5)已知工业上电解熔融的H冶炼金属单质X,向40.0g固体混合物中(仅含H、Fe2O3、SiO2),加入足量稀盐酸,分离得到12.0g固体;滤液中加入过量A溶液,分离得到21.4g固体;则此混合物中元素X的质量分数为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com