
科目: 来源: 题型:阅读理解
(包括2小题,满分共10分)
Ⅰ.玻璃棒是化学实验中常用的仪器,其作用是用于搅拌、过滤或转移液体时引流。下列有关实验过程中,肯定不需要使用玻璃棒进行操作的是_______________________(可以多选)
A.用pH试纸测定Na2CO3溶液的pH
B.从氯酸钾和二氧化锰制取氧气的剩余固体中提取KCl
C.实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
D.配制一定物质的量浓度的氯化钠溶液
E.取某溶液做焰色反应实验,说明该溶液中含有钠元素
F.用适量的蔗糖、浓硫酸和水在小烧杯中进行浓硫酸的脱水性实验
G.促使过饱和的硝酸钾溶液析出晶体
H.用倾析法进行分离、洗涤颗粒较大的沉淀
Ⅱ.二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。ClO2是一种黄绿色的气体,易溶于水。实验室以NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如下:

⑴写出电解时发生反应的化学方程式: ;
⑵除去ClO2中的NH3可选用的试剂是 ;(填序号)
A.饱和食盐水 B.碱石灰 C.浓硫酸 D.水
⑶测定ClO2(如右图)的过程如下:在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用cmol/L硫代硫酸钠标准溶液滴定 (I2+2S2O32-=2I- +S4O62-),共用去VmL硫代硫酸钠溶液。①装置中玻璃液封管的作用是 ;
②请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式 ;
③测得ClO2的质量m(ClO2)= 。(用含c、V的代数式表示)
查看答案和解析>>
科目: 来源: 题型:
(9分)金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和![]() ,并含有3.5%(质量分数)
,并含有3.5%(质量分数)![]() 。
。
(1)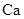 元素在周期表中位置是 ,其原子结构示意图 ;
元素在周期表中位置是 ,其原子结构示意图 ;
(2)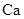 与最活跃的非金属元素A形成化合物D,D的电子式为 ;
与最活跃的非金属元素A形成化合物D,D的电子式为 ;
![]() (3)配平用钙线氧脱鳞的化学方程式:
(3)配平用钙线氧脱鳞的化学方程式:
P + FeO+ CaO == Ca3(PO4)2+ Fe;
(4)将钙线试样溶于稀盐酸,加入过量![]() 溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n,则检测
溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n,则检测![]() 的方法是 (用离子方程式表达);
的方法是 (用离子方程式表达);
(5)取1.6g钙线试样,与水充分反映,生成224ml.H2(标准状况),在向溶液中通入适量的CO2,最多能得到CaCO3 g。
查看答案和解析>>
科目: 来源: 题型:阅读理解
(11分)实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。
(1)理论上硫酸和硝酸的物质的量之比最佳为: ︰ ;
(2)实际上,即使铜粉、硫酸及硝酸都比较纯净,制得的CuSO4·5H2O中还是有可能存在的杂质是 ,除去这种杂质的实验操作称为 。
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
方案甲:以空气为氧化剂。将铜粉在___________(填仪器名称)中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案乙:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质甲调节pH ,铁元素全部沉淀(一般认为铁离子的浓度下降到10-5 mol·L-1,就认为沉淀完全),然后过滤、浓缩、结晶。
已知:Ksp[Cu((OH)2]≈10-22, Ksp[Fe((OH)2]≈10-16, Ksp[Fe((OH)3]≈10-38
请回答下列问题:
①为了使铁元素全部沉淀,应调节pH至少为_________;
②甲物质可选用的是 ;
A.CuCl2 B.NaOH C.Cu2(OH)2CO3 D.CuO E.H2SO4
③反应中加入少量FeSO4对铜的氧化可以起催化作用。其反应过程是:第1步,4Fe2++O2+4H+==4Fe3++2H2O,请写出其第2歩反应的离子方程式 。
方案丙:将铜丝放到一定量的稀硫酸中,加入适量的H2O2,并控温在50℃~60℃,持续反应1 h,也能获得硫酸铜。请回答下列问题:
④反应时温度必须控制在50℃~60℃,温度不宜过高的主要原因是 ;
⑤写出该反应的化学方程式为 。
查看答案和解析>>
科目: 来源: 题型:
(9分)甲、乙、丙是分别由H、C、O、Si、Al、Cu等六种元素中的两种或多种元素组成的化合物。已知甲、乙、丙均不含结晶水,含化合物甲的矿物是工业上电解法冶炼某种常见金属单质的原料,经检测甲是一种高熔点化合物,能溶于强酸、强碱溶液;化合物乙是光导纤维的主要成分;化合物丙为一种呈深蓝色的碱式盐,将34.6g丙隔绝空气加热分解生成24g黑色固体X、无色酸性气体Y(标准状况下,密度为1.96g/L)和水。生成的Y折合成标准状况下的体积为4.48L。固体X难溶于水,能溶于硫酸,形成蓝色溶液。
请回答下列问题:
(1)写出气体Y的结构式 ,化合物丙的化学式 。
(2)写出甲与NaOH溶液反应的离子方程式 。另外,工业上常用甲与焦炭、氯气共热生成化合物丁和CO,而丁仅由两种元素组成,请写出该反应的化学方程式并标出电子转移的方向和数目 。
(3)乙溶于氢氟酸后生成一种极强的二元酸和水。经分析该酸由3种元素组成,其中氟元素的质量分数为79.17%。请写出乙溶于氢氟酸的离子方程式 。
(4)将固体X溶于适量的硫酸,往所得溶液中滴加NaOH浓溶液时,先出现蓝色絮状沉淀,继续滴加NaOH浓溶液并不断振荡,则沉淀消失形成蓝色溶液。综合以上信息可以说明蓝色絮状沉淀物具有__________性(填化学性质)。
查看答案和解析>>
科目: 来源: 题型:
(12分) 实验室可由软锰矿(主要成分为 MnO2)制备 KMnO4,方法如下:软锰矿与过量固体 KOH 和KClO3 在高温下反应,生成锰酸钾(K2MnO4)和 KCl;用水溶解,滤去残渣,滤液酸化后,K2MnO4转变为MnO2和 KMnO4;滤去MnO2沉淀,浓缩滤液,结晶得到深紫色的针状KMnO4请回答:
(1)软锰矿制备K2MnO4的化学方程式是 。
(2)K2MnO4制备KMnO4的离子方程式是 。
(3)配平氧化还原反应方程式:
__ C2O42-+__MnO4-+__H+=__CO2+__Mn2++__H2O
(4)称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份此溶液各25.00 mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25 mol·L-1NaOH溶液至20.00 mL时,溶液由无色变为浅红色。该溶液被中和的H+的物质的量为___mol。
②第二份溶液中滴加0.10 mol·L-1的酸性高锰酸钾溶液至16.00 mL时反应完全,此时溶液颜色由__变为__。该溶液中还原剂的物质的量为___mol。
③原试样中H2C2O4·2H2O的质量分数为_____。
查看答案和解析>>
科目: 来源: 题型:
“扎实推进资源节约和环境保护”是“十二五”时期的主要目标和任务之一,下列做法与这一目标不相符的是
A.推广使用无磷洗衣粉和无氟冰箱 B.对垃圾进行无害化、资源化处理
C.将煤气化或液化,获得清洁燃料 D.加大采矿的力度,获取更多资源
查看答案和解析>>
科目: 来源: 题型:
下列离子方程式书写正确的是
A.在蓝色的淀粉溶液中通入足量SO2后成无色溶液:I2+SO2+2H2O=2I-+SO32-+4H+
B.过量二氧化碳通入偏铝酸钠溶液中:CO2+2H2O+AlO2-=Al(OH)3↓+HCO3-
C.等物质的量的亚硫酸氢铵与氢氧化钠溶液混合NH4++HSO3-+2OH-=SO32-+NH3↑+2H2O
D.碳酸氢镁溶液中加入过量石灰水::Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+MgCO3↓
查看答案和解析>>
科目: 来源: 题型:
一种从植物中提取的天然化合物,其结构为,可用于制作香水。有关该化合物的下列说法不正确的是
A.1 mol该化合物可跟2 molH2 发生加成反应 B.该化合物可使酸性KMnO4溶液褪色
C.1 mol该化合物完全燃烧消耗15.5mol O2 D.1 mol该化合物可与2mol Br2加成
查看答案和解析>>
科目: 来源: 题型:
已检测出pH=1的某未知溶液中含有Al3+和NO3-,检验此溶液中是否大量存在以下6种离子;①ClO- ②NH4+ ③Fe2+ ④K+ ⑤HCO3- ⑥Cl-,其中不必检验就能加以否定的离子是( )
A.①②⑥ B.②③④ C.①③⑤ D.④⑤⑥
查看答案和解析>>
科目: 来源: 题型:
在氧化还原反应的过程中,氧化反应和还原反应同时发生,有关SO2-2e-+2H2O→SO42-+4H+反应的说法错误的是
A.该反应为氧化反应
B.上述反应中若产生0.1 mol SO42-,则消耗SO2的物质的量为0.1mol
C.Fe2(SO4)3、品红两种溶液都能使上述反应进行
D.通入Cl2会降低SO2的漂白作用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com