
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
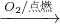 Na2O2
Na2O2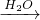 NaOH
NaOH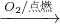 Fe2O3
Fe2O3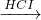 FeCl3
FeCl3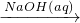 NaAlO2
NaAlO2 Al(OH)3
Al(OH)3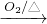 SiO2
SiO2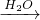 H2SiO3
H2SiO3 CuO
CuO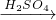 CuSO4.
CuSO4.查看答案和解析>>
科目: 来源: 题型:解答题
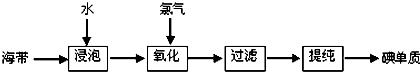
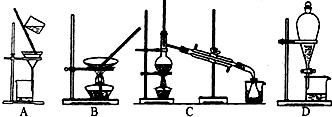
查看答案和解析>>
科目: 来源: 题型:解答题
| 加热前的质量 | 加热后的质量 | |
| m0(坩埚) | m1(坩埚+晶体) | m2(坩埚+无水硫酸铜) |
| 18.269g | 19.420g | 19.011g |
查看答案和解析>>
科目: 来源: 题型:多选题
向三份25mL等浓度的盐酸中分别加入质量不等的NaHCO3和KHCO3的混合物,测得产生气体的体积(不考虑气体溶解)如表中所示:下列说法正确的是
| 编号 | 1 | 2 | 3 |
| m(混合物) | 4.6g | 7.2g | 7.9g |
| V(CO2)(标准状况) | 1.12L | 1.68L | 1.68L |
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
 2C(g)
2C(g)  X(g)+Y(g)
X(g)+Y(g)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com