
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:单选题
 利用常温下氨与氯气能发生置换反应的性质,氯碱工业生产中用来检查氯气是否泄漏,其模拟装置如图.下列有关说法错误的是
利用常温下氨与氯气能发生置换反应的性质,氯碱工业生产中用来检查氯气是否泄漏,其模拟装置如图.下列有关说法错误的是查看答案和解析>>
科目: 来源: 题型:单选题
| 现象 | 解释 | |
| A | 浓HNO3在光照条件下变黄 | 浓硝酸不稳定,生成的有色物质能溶于浓硝酸 |
| B | 向KI-淀粉溶液中通入 适量Cl2溶液变蓝 | Cl2能与淀粉发生显色反应 |
| C | 向某溶液中加入硝酸酸化的氯化钡溶液, 有白色沉淀生成 | 说明该溶液中含有SO42- |
| D | 向盐酸中加入浓硫酸时产生白雾 | 说明浓硫酸具有脱水性 |
查看答案和解析>>
科目: 来源: 题型:单选题

查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
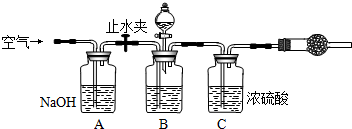
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com