
科目: 来源: 题型:解答题
实验室制配0.4mol/L的NaCl溶液100mL,有以下仪器:
①烧杯 ②100mL量筒 ③1000mL容量瓶 ④500mL容量瓶 ⑤玻璃棒 ⑥托盘天平(带砝码) ⑦药匙
(1)配制时,还缺少的仪器是______.
(2)应称取的NaCl固体的质量是______克.
(3)实验两次用到玻璃棒,其作用分别是:______、______.
(4)配制时,一般过得程是:①计算 ②称量 ③溶解 ④冷却 ⑤转移 ⑥洗涤 ⑦摇匀 ⑧定容 ⑨摇匀.其中最后一次摇匀的方法是______(a、左右旋转摇匀B、上下颠到反复摇匀)
查看答案和解析>>
科目: 来源: 题型:解答题
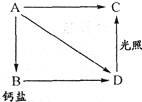 图中A、B、C、D是含氯元素的物质.A为黄绿色的气体B为漂白粉的有效成分.
图中A、B、C、D是含氯元素的物质.A为黄绿色的气体B为漂白粉的有效成分.查看答案和解析>>
科目: 来源: 题型:填空题
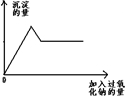 某无色透明溶液中可能含Mg2+、Al3+、Fe3+、Cu2+、NH4+、K+中的几种离子.当加入过量的过氧化钠时,有无色无味的气体产生,同时生成白色沉淀.加入的过氧化钠的量与产生沉淀的量之间的关系如右图所示,试回答:
某无色透明溶液中可能含Mg2+、Al3+、Fe3+、Cu2+、NH4+、K+中的几种离子.当加入过量的过氧化钠时,有无色无味的气体产生,同时生成白色沉淀.加入的过氧化钠的量与产生沉淀的量之间的关系如右图所示,试回答:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| T/K | 303 | 313 | 323 | 353 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
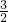 O2(g)△H1=+765.2kJ?mol-1
O2(g)△H1=+765.2kJ?mol-1 2NH3(g).设在容积为2.0L的密闭容器中充入0.60mol N2(g)和1.60molH2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为
2NH3(g).设在容积为2.0L的密闭容器中充入0.60mol N2(g)和1.60molH2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为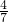 .计算
.计算 N2(g)+3H2(g)的平衡常数.
N2(g)+3H2(g)的平衡常数.查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
 Cr2(SO4)3
Cr2(SO4)3查看答案和解析>>
科目: 来源: 题型:单选题
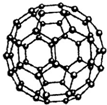 图所示)中含有的N-N键数目为1.5NA
图所示)中含有的N-N键数目为1.5NA查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com