
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
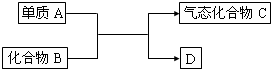 如图是一些重要工业生产的转化关系(反应条件略去):
如图是一些重要工业生产的转化关系(反应条件略去): ,请写出该反应的化学方程式______.
,请写出该反应的化学方程式______.查看答案和解析>>
科目: 来源: 题型:解答题
| 粒子代码 | a | e | I |
| 原子核数 | 单核 | 两核 | 四核 |
| 粒子的电荷数 | 一个单位正电荷 | 一个单位负电荷 | 0 |
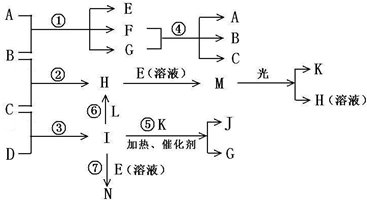
 的电子式______;
的电子式______;查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
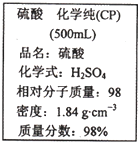 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法错误的是
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法错误的是查看答案和解析>>
科目: 来源: 题型:解答题
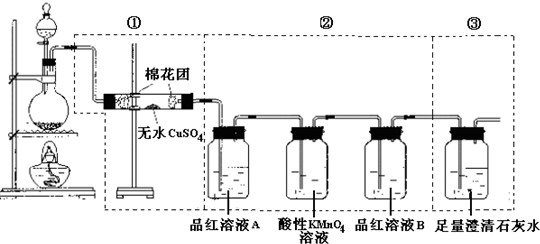
查看答案和解析>>
科目: 来源: 题型:解答题
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
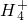 水解的缘故.则NH4Cl在重水(D2O)中水解的离子方程式是______.
水解的缘故.则NH4Cl在重水(D2O)中水解的离子方程式是______.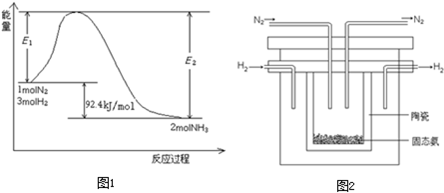
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com