
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
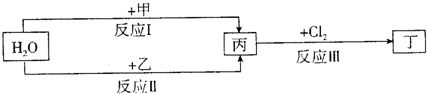
查看答案和解析>>
科目: 来源: 题型:单选题
 2Cu+4H++O2↑
2Cu+4H++O2↑查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
 +H2↑
+H2↑查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题

| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释或结论 |
| i | ______ | 棉球变为白色,微热后又恢复红色 | |
| ii | ______ | 棉球变为浅绿色 | 离子方程式:______ 结论:______ |
| iii | Na2S溶液 | 棉球变为浅黄色 | 解释:浅黄色物质是______ 结论:______ |
| iv | ______ | 棉球变为红色 | 化学方程式:______ 结论:该气体属于酸性氧化物 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com