
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
 2Fe2O3+8SO2来制取SO2,如果用含杂质10%的黄铁矿1t.
2Fe2O3+8SO2来制取SO2,如果用含杂质10%的黄铁矿1t.查看答案和解析>>
科目: 来源: 题型:单选题
 2Fe+Al2O3,下列说法中正确的是
2Fe+Al2O3,下列说法中正确的是查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:解答题
| 实验步骤 | 现象 | 结论 |
| ______ | ______ | 产品不合格 |
查看答案和解析>>
科目: 来源: 题型:解答题
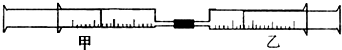
| 实验序号 | 甲针筒内物质 | 乙针筒内物质 | 甲针筒的现象 |
| 1 | 10mL FeSO4溶液 | 10mL NH3 | 生成白色沉淀,后变色 |
| 2 | 15mL H2S | 10mL SO2 | 活塞自动向内移动,析出浅黄色固体 |
| 3 | 10mL Cl2 | 40mL NH3 | |
| 4 | 25mL混合气体 | 10mL H2O(l) | 剩有无色气体,活塞自动向内移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com