
科目: 来源: 题型:单选题
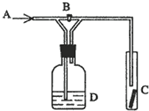 在图所示的实验装置中,先打开活塞B,在A处通入干燥氯气,C中红色布条颜色无变化;再关闭活塞B,继续在A处通入干燥氯气,C处红色布条颜色褪去.可见D瓶中盛有的溶液是
在图所示的实验装置中,先打开活塞B,在A处通入干燥氯气,C中红色布条颜色无变化;再关闭活塞B,继续在A处通入干燥氯气,C处红色布条颜色褪去.可见D瓶中盛有的溶液是查看答案和解析>>
科目: 来源: 题型:解答题
 二氧化硫和氯气是中学化学中的常见气体,探究二者的制法和性质是十分重要的课题.
二氧化硫和氯气是中学化学中的常见气体,探究二者的制法和性质是十分重要的课题.
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
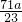 %
%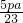 mol?L-1
mol?L-1 %
%查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
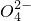 +3Ba2++6OH-═2Al(OH)3↓+3BaSO4
+3Ba2++6OH-═2Al(OH)3↓+3BaSO4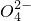 +3Cl-+H2O+H+
+3Cl-+H2O+H+查看答案和解析>>
科目: 来源: 题型:多选题
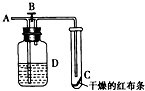 如图所示,在A处通入氯气,关闭B阀时,C处干燥的红布条看不到明显现象;当打开B阀后,C处于燥的红布条逐渐褪色.则D瓶中盛放的溶液可能是
如图所示,在A处通入氯气,关闭B阀时,C处干燥的红布条看不到明显现象;当打开B阀后,C处于燥的红布条逐渐褪色.则D瓶中盛放的溶液可能是查看答案和解析>>
科目: 来源: 题型:解答题
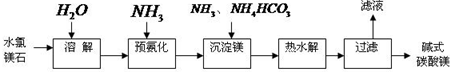
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com