
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
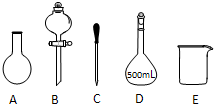 实验室需要1.0mol?L-1NaOH溶液400mL,根据溶液的配制情况回答下列问题:
实验室需要1.0mol?L-1NaOH溶液400mL,根据溶液的配制情况回答下列问题:查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
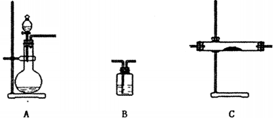 某小组想验证Mg与二氧化碳的反应.请从下图中选用装置(可重复使用)进行该实验.现提供浓硫酸、稀盐酸、稀硫酸、镁粉、大理石、澄清的石灰水、饱和的NaHCO3溶液、饱和的Na2CO3溶液(加热的仪器已略去).
某小组想验证Mg与二氧化碳的反应.请从下图中选用装置(可重复使用)进行该实验.现提供浓硫酸、稀盐酸、稀硫酸、镁粉、大理石、澄清的石灰水、饱和的NaHCO3溶液、饱和的Na2CO3溶液(加热的仪器已略去).| 选用的装置(填序号) | 加入的试剂 |
| ______ | ______ |
| ______ | ______ |
| ______ | ______ |
| ______ | ______ |
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 P
P Q
Q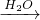 M+P
M+P查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com