
科目: 来源: 题型:解答题
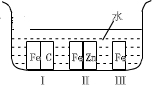
 NO+O、②2NO+O2=2NO2、③O2+O=O3.则总反应可表示为______,NO2在其中起了______作用.
NO+O、②2NO+O2=2NO2、③O2+O=O3.则总反应可表示为______,NO2在其中起了______作用.查看答案和解析>>
科目: 来源: 题型:解答题
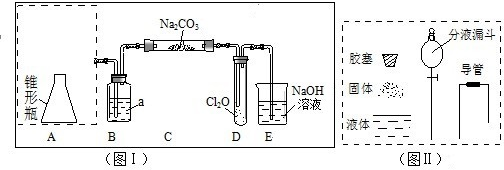
| 实验步骤 | 现象和结论 |
| 步骤一:取C中的少量固体样品于试管中,滴加足量蒸馏水至完全溶解,然后将溶液分别置于a、b试管中. | |
| 步骤二:向a试管中滴加BaCl2溶液,静置. | 无明显现象,证明固体中不含Na2CO3 |
| 步骤三:______ ______ | ______ ______ |
| 步骤四:______ ______ | ______ 则证明固体中含有NaCl. |
查看答案和解析>>
科目: 来源: 题型:解答题
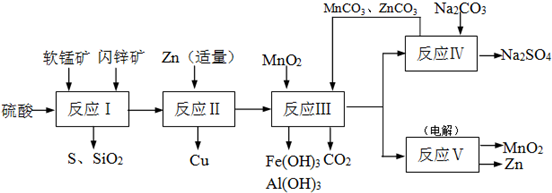
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Zn(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 5.4 |
| 完全沉淀pH | 4.1 | 5.2 | 8.0 |
查看答案和解析>>
科目: 来源: 题型:解答题
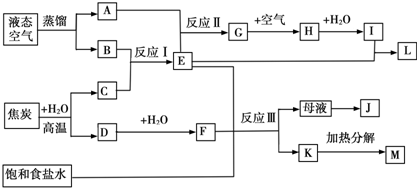
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
 =1012的溶液:Fe2+、Mg2+ NO3-,Cl-
=1012的溶液:Fe2+、Mg2+ NO3-,Cl-查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com