
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:单选题
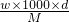
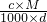
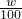
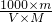
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:单选题
 H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH- 2SO3
2SO3查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:单选题
| 操作 | 现象 | |
| A | 饱和食盐水中滴加少量浓盐酸,振荡 | 溶液变浑浊 |
| B | 饱和CaCl2溶液中通入CO2,振荡 | 溶液变浑浊 |
| C | 澄清石灰水中通入足量的CO2,振荡 | 溶液变浑浊 |
| D | 氨水中滴加少量AgNO3溶液,振荡 | 溶液变浑浊 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验操作 | 预期现象与结论 |
| 步骤1:取少量待测液放入试管1中,滴加过量lmol/L氯化钡溶液. | 若不出现浑浊,则溶液中不存在SO32-, 若出现浑浊,则溶液中可能含有SO32-. |
| 步骤2:若出现浑浊,静置一段时间后,将上层清液倒入试管2中.往试管1中加入蒸馏水洗涤沉淀,静置后弃去上层清液,再加入______. | ______ |
| 步骤3:______ | ______ |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com