
科目: 来源:不详 题型:填空题
查看答案和解析>>
科目: 来源:不详 题型:填空题
查看答案和解析>>
科目: 来源:厦门一模 题型:问答题
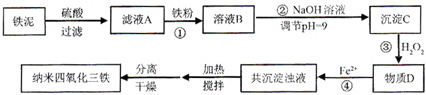
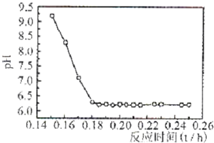
| 实验序号 | 双氧水(mL) | pH | 反应时间 |
| 1 | 0.5 | 11 | 3 |
| 2 | 0.4 | 11 | 3 |
| 3 | 0.6 | 11 | 3 |
| 4 | 0.5 | 10 | 3 |
| 5 | |||
| 6 | |||
| 7 |
查看答案和解析>>
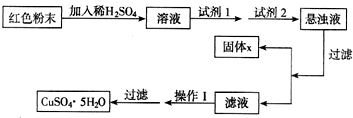
科目: 来源:清远模拟 题型:问答题
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
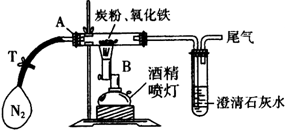
| 操作步骤及实验现象 | 简答 |
| ①称取3.2g氧化铁与2g炭粉均匀混合,放入48.48g的玻璃管中,按如图装置连接 | |
| ②加热前,先通一段时间纯净、干燥的氮气 | 其目的是:______ |
| ③夹紧T处弹簧夹,加热一段时间,澄清石灰水变浑浊 | 该现象说明:______ |
| ④完全反应后,冷却至室温,称得玻璃管和固体的总质量为52.24g |
查看答案和解析>>
科目: 来源:南京二模 题型:单选题
| A.氧化铁可用来制造红色油漆和涂料 |
| B.二氧化硫可用来加工食品,使食品增白 |
| C.硅胶可用作实验室和袋装食品、瓶装药品等的干燥剂 |
| D.浸泡过高锰酸钾溶液的硅土可用来延长果实或花朵的成熟期 |
查看答案和解析>>
科目: 来源:广东模拟 题型:问答题
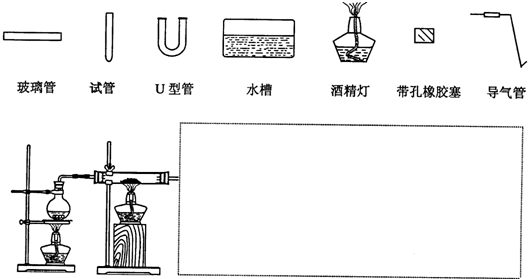
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com