
2009年老河口市一中高二年级1月月考
化 学 试 题
命题人:李 军 满分:108 时间:90分钟
可能用到的相对原子质量:H―1 O―16 Mg―24 Al―27 Fe―56 Cu―64
第Ⅰ卷 (选择题 共48分)
一、每小题只有一个选项符合题意(3分×16=48分)
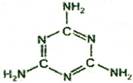 1. 2008年9月,中国爆发三鹿婴幼儿奶粉受污染事件,导致食用了受污染奶粉的婴幼儿产生肾结石病症,其原因是奶粉中含有三聚氰胺。三聚氰胺也被人称为“蛋白精”,价格便宜。牛奶和奶粉添加三聚氰胺,主要是因为它能冒充蛋白质。三聚氰胺的结构如右图,下列关于三聚氰胺的说法错误的是
1. 2008年9月,中国爆发三鹿婴幼儿奶粉受污染事件,导致食用了受污染奶粉的婴幼儿产生肾结石病症,其原因是奶粉中含有三聚氰胺。三聚氰胺也被人称为“蛋白精”,价格便宜。牛奶和奶粉添加三聚氰胺,主要是因为它能冒充蛋白质。三聚氰胺的结构如右图,下列关于三聚氰胺的说法错误的是
A.有机物 B.无机物
C.化合物 D.分子式为C3N6H6
3. 下列说法正确的是
A.铁位于元素周期表第四周期第ⅧB族 B.Fe3+和Fe2+都具有氧化性
C.铁属于黑色金属,纯铁是黑色的 D.Fe(OH)2为灰绿色
4. 进行下列反应后,所得溶液中一定只含一种溶质的是
A.向MgSO4、H2SO4的混合溶液中加入过量的氢氢化钡溶液
B.Fe3O4溶于适量的稀盐酸中
C.向NaOH溶液中滴入少量的AlCl3溶液
D.NaOH溶液与CH3COOH溶液反应后所得到的pH>7的溶液
5. 在Al(OH)3、Al2O3、A1、NaHCO3、(NH4)2S等物质中,既能与NaOH溶液反应,又能与盐酸
反应的有
A.2种 B.3种 C.4种 D.5种
6. 将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应H2(g)+Br2(g) 2HBr(g);△H<0,达到平衡时Br2(g)的转化率为a;若初始条件相同,绝热(与外界不发生热交换)条件下进行上述反应,平衡时Br2(g)的转化率为b。则a与b的关系是
2HBr(g);△H<0,达到平衡时Br2(g)的转化率为a;若初始条件相同,绝热(与外界不发生热交换)条件下进行上述反应,平衡时Br2(g)的转化率为b。则a与b的关系是
A.a>b B.a=b C.a<b D.无法确定
7. 据媒体报道:以氢氧燃料电池为动力的公交车即将在北京试运行。质子交换膜燃料电池 (PEMFC)常作为电动汽车的动力源。该燃料电池以氢气为燃料,空气为氧化剂,铂为电极,导电离子是H+。下列对该燃料电池的描述正确的是
①正极反应为:O2+4H++4e―= 2H2O ②电子由负极流向正极
③总的化学反应为:2H2+O2 2H2O ④氢离子通过电解质向正极移动
2H2O ④氢离子通过电解质向正极移动
A.①②③ B.②③④ C.①②④ D.①②③④
8. 下列说法正确的是
A.生铁的熔点比纯铁高 B.在潮湿的空气中纯铁比生铁易腐蚀
C.镁的蒸气不能在N2中冷却 D.FeCl2不能由化合反应得到
9. 一定温度下,某密闭容器中充人a mol A和b mol B,发生反应:aA(g)+bB(g) cC(g),达到
cC(g),达到
平衡后,下列说法中一定正确的是
A.保持容器容积不变,再通人一定量的C,建立新的平衡状态时,A的体积分数与原平衡相同
B.保持容器内气体压强不变,再通人稀有气体,平衡不移动
C.平衡时,A浓度变化表示的正反应速率是用B的浓度变化表示的逆反应速率的a/b倍
D.保持容器容积不变,减少B的物质的量,建立新的平衡状态时,A的转化率升高
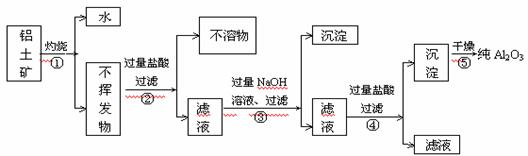 10. 工业上用铝土矿(主要成分为Al2O3?xH2O、Fe2O3、SiO2等)提取纯Al2O3做冶炼铝的原料,提取时操作过程如下图,指出图中操作错误的是
10. 工业上用铝土矿(主要成分为Al2O3?xH2O、Fe2O3、SiO2等)提取纯Al2O3做冶炼铝的原料,提取时操作过程如下图,指出图中操作错误的是
A.④⑤ B.③④ C.②⑤ D.①②
11. 向某晶体的水溶液中加入FeCl2的溶液后,无明显变化,当滴加几滴溴水后,混合液出现血红色。那么,由此得出下列的结论错误的是
A.该晶体中一定含有SCN- B.Fe3+与SCN-形成了血红色Fe (SCN)3难溶物
C.Fe2+被Br2氧化为Fe3+ D.Fe2+与SCN-不能形成血红色物质
12. 下列有关金属冶炼的说法中,不正确的是
A.用电解熔融氯化钠的方法得到活泼金属钠
B.在加热的情况下利用氢气还原三氧化二铝得到金属铝
C.用铝热反应原理炼得熔点较高的金属铬
D.直接加热HgO得到金属Hg
13. 下列化学用语表述完全正确的是
A.Al(OH)3的电离方程式:Al(OH)3 Al3++3OH-
Al3++3OH-
B.Fe3O4溶于氢碘酸:Fe3O4+8H+=2Fe3++ Fe2++4H2O
C.H2S通入FeCl3溶液中:2Fe3+ + H2S = S ↓+ 2Fe2+ + 2H +
D.铝热反应:2Al+3MgO(g) Al2O3+3Mg
Al2O3+3Mg
14. 有关Al与NaOH溶液反应的说法中,正确的是
A.铝是还原剂,其还原产物是NaAlO2 B.NaOH是氧化剂,其还原产物是H2
C.铝是还原剂,H2O和NaOH都是氧化剂 D.H2O是氧化剂,Al被氧化
15. 下列叙述中不正确的是
A.在0.1 mol/L CH3COOH溶液中,c(H+)=c(CH3COO-)+c(OH-)
B.常温下将10 mL 0.02 mol/L NaOH溶液与10 mL 0.02 mol/L H2SO4溶液充分混合,
若混合后溶液的体积为20 mL,则混合后溶液的pH=2
C.在0.1 mol/LNaHS溶液中,c(H+)+ c(H2S)=c(S2-)+c(OH-)
D.在0.1 mol/L Na2CO3溶液中,
16. 某有机物的键线式如图所示,其名称正确的是
二、本大题包括6个小题,共60分
17.(8分)在烃的分子结构中,若每减少2个氢原子,则相当于碳碳间增加一对共用电子。试回答下列问题:
(1)分子式为CnH2n+2的烃分子中碳碳间共用电子对数为 ;
(2)分子式为CnH2n-6的烃分子中碳碳间共用电子对数为 ;
(3)Cx可看作为烃去氢后的产物,若某物质分子中碳碳间共用电子对数为160,则符合
该条件的碳单质的化学式为 ;
(4)若某单烯烃中碳碳间共用电子对数为80,则该单烯烃的分子式为 。
18.(10分)航天飞机常采用新型燃料电池作为电能来源,燃料电池一般是指用H2、CH4、CO、C2H5OH等可燃物质与O2一起构成的电池装置,它可直接将化学能转化为电能。我国发射的载人宇宙飞船是采用先进的甲烷电池为电源,该电池以KOH溶液为电解质,其总反应的化学方程式为CH4+2O2+2OH-=CO32-+3H2O
(1)负极上的电极反应为 。
正极上的电极反应为 。
(2)消耗标准状况下的5.6LO2时,有 mol电子发生转移。
(3)开始放电时,正极附近溶液的pH (填“增大”、“减小”或“不变”)
(4)为了保持该电池使用寿命应该
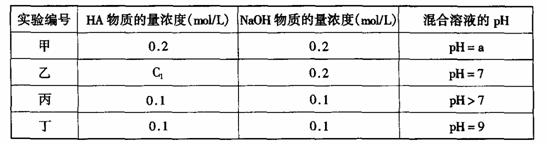
19. (13分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
 请回答:
请回答:
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸_______________________________________。
(2)不考虑其它组的实验结果,单从乙组情况分析,c1是否一定等于0.2mol/L ______(选填“是”或“否”)。混合溶液中离子浓度c(A-)与c(Na+)的大小关系是________。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HA是________酸(选填“强”或“弱”);若用HA溶液和NaOH溶液完成中和滴定实验,则应选用_______________作指示剂。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=_____________mol/L
写出该混合溶液中下列算式的精确结果(不能做近似计算,回答准确值,结果不一定要化简)。
c(Na+)-c(A―)=___________mol/L。
20. (12分) A―J是中学化学常见的物质,它们之间的转化关系如下图所示(部分产物已略去)。已
知A是由两种元素形成的化合物,D是一种红棕色固体,H的焰色反应呈黄色。
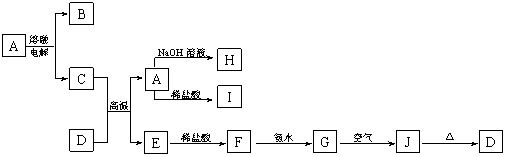 |
请回答下列问题:
(1)B物质的化学式为_________,H物质的名称为________________。
(2)G→J的化学方程式为___________________________________。
(3)D物质与盐酸反应所得溶液显酸性的原因是(用离子方程式表示):_______________。
(4)含杂质的E在潮湿的空气中易发生电化学腐蚀,其正极的电极反应式为:___________。
(5)写出一个满足下列两个条件的置换反应: ___________________________________。
①在A――J中找一种单质作为反应物;②生成物之一是具有磁性的氧化物。
21.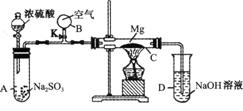 (9分) 按下图装置进行如下实验,请用你所学知识完成下题:
(9分) 按下图装置进行如下实验,请用你所学知识完成下题:
先关闭K,使A中反应进行,加热玻璃管C,可观察到C管中发生耀眼白光,产生白烟,管壁上附有淡黄色物质。实验完成后将C管中固体全部加入盐酸中,有臭鸡蛋气味的气体生成。
(1)C中的Mg应放在不锈钢垫片上而不能直接接触管壁,是因为 。
(2)停止实验时,先打开K,再停止滴加浓硫酸并熄灭酒精灯,橡胶气胆B在实验中的作用是
。
(3)C中全部反应产物有 、 、 (填化学式)。
22. (8分)有A、B两只密闭容器,A容器有一个移动的活塞,能使容器保持恒压,B容器保持恒容,起始时向A容器中充入2molSO2、1molO2,向B容器中充入4molSO2,
2molO2并使A、B两容器的体积都为 2SO3(g),平衡时,A容器的体积为
2SO3(g),平衡时,A容器的体积为
(1)A容器中SO2的转化率为_________
(2)A、B两容器中SO2转化率是A___________B(填“?”“?”“?”)。
(3)当A、B两容器连接后,打开开关使互通一段时间后又达到平衡时,A容器的体积为_______L。(设连通管中气体体积不计)
单选题(3分×16=48分)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
B
D
B
A
D
A
C
C
C
A
B
B
C
D
D
D
非选择题(共60分)
17.(8分)
(1)n-1 ; (2)n+3 ; (3)C80 ; (4)C80H160
18.(10分,每空2分)
(1)CH4+10OH--8e-=CO32-+7H2O 2O2+4H2O+8e-=8OH-
(2)1 (3)增大 (4)补充KOH
19.(13分)
(1)a=7时HA是强酸,a>7时HA是弱酸(2分)
(2)否(2分) C(2分)
(3)弱(1分) 酚酞(2分)
(4)10-5 (2分) (
20.(12分)
(1)O2(2分) 偏铝酸钠(2分)
(2)4Fe(OH)2+2H2O+O2ㄔ4Fe(OH)3(2分)
(3)Fe3++3H2O Fe(OH)3+3H+(2分)
Fe(OH)3+3H+(2分)
(4)2H2O+ O2+4e-=4OH-(2分)
(5)3Fe+4H2O(g) Fe3O4+4H2(2分)
Fe3O4+4H2(2分)
21. (9分)
(1)加热条件下,Mg与玻璃中的SiO2反应腐蚀玻璃(3分)
(2)防止C降温时因C中气体压强减小而引起D中溶液的倒吸(3分)
(3)MgO(1分) MgS(1分) S(1分)
22.(8分) (1)60%(3分) (2)<(2分) (3)1.4(3分)

 化学答题卡
化学答题卡
单选题(3分×16=48分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
答案
非选择题(共60分)
 17.(8分)
17.(8分)
(1)_______________ ___
(2)______ ___
(3)____________________________
 (4)_______________________ ____
(4)_______________________ ____
18.(10分)
(1)________________ ____________
_____________________ _______
 (2)___________(3)_______________(4)_________________
_________
(2)___________(3)_______________(4)_________________
_________
19.(13分)
(1)__________ __________ ______
(2)____________;___
 (3)____________;_______________
(3)____________;_______________
(4)______________________;_______________________
 20.(12分)(1)_____________;__________________
20.(12分)(1)_____________;__________________
(2)_____________________________________________________________________
(3)__________________________________________________________________
(4)____________________________________________________________________
(5)____________________________________________________________________
 21.(9分)
21.(9分)
(1) ___________ ________
___________
(2)____________________________________ ________
(3)______ ________________________ __
 22.(8分)
22.(8分)
(1) _____ ____
(2) _ (3) ____ __
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com