|
X Y Z A NO2 SO2 BaCl2 B NH3 O2 Al2(SO4)3 C NH3 CO2 NaCl(饱和) D CO O2 Ca(OH)2 所示),一定没有沉淀生成的是 ( )
试题详情
9.下列溶液中离子浓度关系表示正确的是 ( ) A.NaHCO3溶液中:c(H+) + c(Na+)=c(OH-)
+ c(CO32-) + c(HCO3-) B.pH=3的CH3COOH与pH=11的NaOH溶液等体积混合后的溶液中:c(H+)<c(OH-) 试题详情
C.0.1mol/L的NH4Cl溶液中,c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后的溶液中:[y1]
2c(Na+)=c(CH3COOH)
+ c(CH3COO-) 试题详情
10.①pH=0的盐酸 ②0.5mol?L-1盐酸 ③0.1 mol?L-1的NH4Cl溶液 试题详情
④0.1 mol?L-1的NaOH溶液 ⑤0.5 mol?L-1的NH4Cl溶液 以上溶液中水电离的c(H+)由大到小的顺序是 ( ) A.⑤③④②① B.①②③⑤④ C.①②③④⑤ D.⑤③④①② 试题详情
11.根据相关化学原理分析,下列推断正确的是 ( ) A.若X的质子数为a,中子数为b,则X的质量数为:a-b B.若弱酸HA的酸性强于弱酸HB,则同浓度钠盐溶液的碱性比较为:NaA<NaB C.若R2-和M+的电子层结构相同,则原子序数的比较为:R>M 试题详情
 D.若反应A2+2D- 2A-+D2,则氧化性的比较为:D2>A2 D.若反应A2+2D- 2A-+D2,则氧化性的比较为:D2>A2
试题详情
 12.将1mol SO2和1mol O2通入一容积不变的密闭容器中,在一定温度和催化剂作用下,发 12.将1mol SO2和1mol O2通入一容积不变的密闭容器中,在一定温度和催化剂作用下,发
试题详情
生反应:2SO2(g) + O2(g) 2SO3(g)。反应达到平衡时SO3为0.3 mol。若此时移走0.5mol 试题详情
O2和0.5mol SO2,则重新达到平衡后,SO3的物质的量为下列的 ( ) 试题详情
试题详情
C.小于0.15mol
D.大于0.15mol,小于0.3mol 试题详情
二、填空题。(本题包括3小题。共45分) 22.(15分)以下框图中A~M是中学化学常见的物质,其中A、E是金属,F和J为气体单 质,其余均为化合物或其溶液,C为淡黄色固体,D为红棕色粉末,M为红褐色固体。 请回答下列问题: 试题详情

(1)
写出B的化学式_________;指出C物质中所包含的化学键类型________________。 (2)若将H溶液加热蒸干、灼烧,最终得到的固体物质的化学式___________。 (3)写出①反应的离子方程式__________________________________。 (4)写出②、③反应的化学方程式 ②
; ③___________________________________________________________。 试题详情
23.(14分)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯 (C3H6)。 (1)丙烷脱氢可得丙烯。 试题详情
已知:C3H8 (g)===
CH4(g) + HC≡CH(g) + H2(g) H1= +156.6 kJ?mol-1 H1= +156.6 kJ?mol-1 试题详情
CH3CH=CH2(g)
=== CH4(g) + HC≡CH(g) H2= +32.4 kJ?mol-1 H2= +32.4 kJ?mol-1 试题详情
 则相同条件下,反应C3H8(g) CH3CH=CH2(g)
+ H2(g)的 则相同条件下,反应C3H8(g) CH3CH=CH2(g)
+ H2(g)的 H=_______ H=_______
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解 质是熔融碳酸盐。电池反应方程式为__________________________________;放电 时,CO32-移向电池的_______(填“正”或“负”)极。 (3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平 试题详情
衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol?L-1。若忽略水的电离及H2CO3的 试题详情
 第二级电离,则H2CO3 HCO3-
+ H+的平衡常数K1=_________。 第二级电离,则H2CO3 HCO3-
+ H+的平衡常数K1=_________。
试题详情
试题详情
(4)常温下,0.1 mol?L-1 NaHCO3溶液的pH大于8,则溶液中c(H2CO3)______c(CO32-) (填“>”“=”或“<”),原因是_______________________________________________ (用离子方程式和必要的文字说明)。 试题详情
24.(16分)熟悉和使用中学化学实验中常见仪器及用品,是化学学习的基本要求。试回答以下问题: (1)在仪器:a.分液漏斗 b.试剂瓶 c.集气瓶 d.滴定管 e.容量瓶 f.量筒 g.托盘天平中,标有“0”刻度的是(填序号)。
。 (2)“磨砂”是增加玻璃仪器密封性的一种处理工艺。在下列仪器中,没有用到 “磨砂”工艺处理的有(填序号)
。 a.试管
b.分液漏斗 c.带滴管的试剂瓶(滴瓶) d.集气瓶 e.酸式滴定管 f.碱式滴定管, (3)用装置甲、乙、丙和乳胶管组成一套装置(气密性已检查),可用于制取并收集NH3或HCl气体。可供选择的液体试剂有:浓硫酸、浓盐酸、浓氨水,丙中试剂为紫色石蕊试液。请回答下列问题: 试题详情
|
|
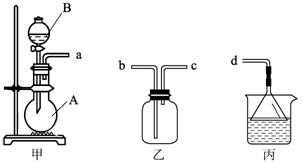
①若制取某气体的过程中,丙中的石蕊试液变红,且烧瓶中的试剂A与分液漏斗中的试剂B均为无色液体,则试剂A为
,制取该气体利用了B的性质有
、
。 通过丙中紫色石蕊溶液变红或变蓝,说明乙中气体已集满。若石蕊试液变蓝,则烧瓶甲中应加入的固体试剂A为
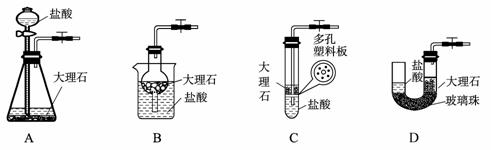
; ②若在乙中收集氨气,气体流经装置的顺序是:a→ → →d(填接口代号)。 (4)下图中的装置D是实验室制备CO2的简易装置图,用该装置制备CO2可起到随开随用、随关随停的效果。下图中的装置A、B、C也可起到相同效果的有 (填写编号)。
试题详情
选考题(每科选做1题) 试题详情
31.化学选考题(13分) A.(物质结构与性质) 由短周期元素组成的A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有 如图所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,虚线不表示化 学键或分子间作用力,X、Y可以相同也可以不同)。A、B的晶体类型相同。单质A的 同素异形体能与B物质发生置换反应。C、D、E、F含有相等的电子数,且D是阳离子, D与F的组成元素相同。C、E、F的晶体类型相同,由E构成的物质常温下呈液态。 试题详情
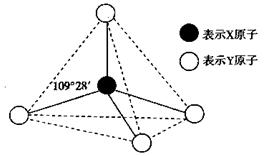
(1)写出单质A的同素异形体与B物质发生置换反应的化学方程式_______________; 与A同主族的第四周期元素基态原子的电子排布式为________________。 (2)上述六种物质或粒子的组成元素中有三种处于同一周期,请写出这三种元素第一电 离能由大到小的顺序______________(用元素符号回答)。 (3)上述六种物质或粒子中互为等电子体的是_________________(写化学式)。 (4)F分子的电子式为___________, F易溶于E,其原因是________________。 B.(有机化学) 咖啡酸(下式中的A)是某种抗氧化剂成分之一,A结构中苯环上有3个取代基,且取 代基中不含支链,A遇FeCl3溶液发生显色反应。A有如下转化关系: 试题详情

(1)咖啡酸A中含氧官能团名称为_____________; (2)写出A生成D的化学反应方程式:______________________________________,该 反应的反应类型为___________________。 (3)a mol咖啡酸A与足量钠反应生成气体(标准状况)_______L。 (4)蜂胶的主要成分(分子式为C17H16O4)是由咖啡酸A和一种芳香醇E发生酯化反应 试题详情
 生成的,已知E的芳香醇类同分异物体有5种,其中三种为
生成的,已知E的芳香醇类同分异物体有5种,其中三种为
请写出另外两种_________________________________________。 化学答案 试题详情
6.A 7.D 8.D 9.D 10.A 11.B 12.C 试题详情
22.(15分)(1)Al2O3(2分) 离子键、非极性键(或共价键)(2分) (2)Fe2O3(2分) 试题详情
  (3)2Al+2OH-+2H2O 2AlO2-+3H2↑(3分) (3)2Al+2OH-+2H2O 2AlO2-+3H2↑(3分)
试题详情
 (4)4Fe(OH)2+O2+2H2O 4Fe(OH)3(3分) 2Al+Fe2O3 2Fe+Al2O3(3分) (4)4Fe(OH)2+O2+2H2O 4Fe(OH)3(3分) 2Al+Fe2O3 2Fe+Al2O3(3分)
试题详情
23.(14分)(1)124.2 kJ?mol-1(3分) 试题详情
 (2)C3H8+5O2 3CO2+4H2O(2分) 负(2分) (2)C3H8+5O2 3CO2+4H2O(2分) 负(2分)
试题详情
试题详情
  (4)>(2分) HCO3-+H2O H2CO3+OH- HCO3- H++CO32-
HCO3-的水解 (4)>(2分) HCO3-+H2O H2CO3+OH- HCO3- H++CO32-
HCO3-的水解
程度大于电离程度(2分) 试题详情
24.(16分)(1)(2分)dg (2) (2分)af (3) ① 浓盐酸(2分);吸水性(2分),溶于水放出大量热(2分);NaOH或CaO或碱石灰(2分); ② cb(2分) (4)(2分)B 试题详情
试题详情
 (1)2C+SiO2===Si+2CO↑(3分) 1s22s22p63s23p63d104s24p2(2分) (1)2C+SiO2===Si+2CO↑(3分) 1s22s22p63s23p63d104s24p2(2分)
(2)N>O>C(2分) (3)CH4、NH4+(2分) (4) (2分) 水和氨分子之间形成氢键(2分) 试题详情
 B.(1)羧基、羟基(2分) B.(1)羧基、羟基(2分)
(2)
(3分) 加成反应(1分) 试题详情
  (3)33.6a(3分) (3)33.6a(3分)
(4)
(2分)
(2分) [y1]Y cy 试题详情
| | | 