
2008―2009学年河北省唐山一中高三调研考试化学试题
卷Ⅰ(选择题 共60分)
一.选择题(共12小题,每小题2分,计24分。每小题只有一个选项正确)
2.碘跟氧可以形成多种化合物,其中一种称为碘酸碘,在该化合物中,碘元素呈+3和+5两种价态,这种化合物的化学式是
A. I2O3 B.I2O4 C.I4O7 D.I4O9
3.实验室中测定10000个H2O的相对分子质量,若考虑同位素的存在,已知O有两种同位素16O、18O,H有三种同位素1H、2H、3H,可测得相对分子质量有
A.1种 B.7种 C.12种 D.1000种
4.下列表达方式正确的是
A.CCl4的电子式: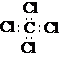 B.MgCl2的电子式:
B.MgCl2的电子式: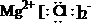
5.下列实验操作正确的是
A.使用容量瓶配制溶液,移液时应洗涤烧杯和玻璃棒2~3次
B.用50mL量筒量取2.5mL稀盐酸
C.用托盘天平称量
D.用托盘天平称量NaOH固体时,不能直接放在盘上称,应放在纸上称
6.设NA为阿伏加德罗常数,下列说法中正确的是
A.在含4 mol Si―O键的SiO2晶体中,氧原子的数目为2NA
B.中和热57.3kJ/mol表示反应生成NA个水分子时一定放出57.3kJ热量
C.12.5 mL 16 mol/L浓硫酸与足量铜反应,生成SO2的分子数约为0.1 NA
D.常温下含有NA个NO2、N2O4分子的混合气体,降温至标准状况,其体积约为
7.在一固定容积的密闭容器中充入1molNO2,一定温度下建立如下平衡:2NO2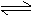 N2O4, 此时NO2的转化率为x%,若再充入1molNO2,在温度不变的情况下,达到新的平衡时,测得NO2的转化率为y%,则x、y的大小关系正确的是
N2O4, 此时NO2的转化率为x%,若再充入1molNO2,在温度不变的情况下,达到新的平衡时,测得NO2的转化率为y%,则x、y的大小关系正确的是
A.x>y B.x<y C.x=y D.不能确定
8.将淀粉浆和淀粉酶的混合物放入玻璃纸袋中扎好,浸入流动的温水中,相当长一段时间后,取袋内液体分别与碘水、新制氢氧化铜(加热)和浓硝酸(微热),其现象是
A.显蓝色、无现象、显黄色 B.显蓝色、红色沉淀、无现象
C.无现象、变黑色、显黄色 D.无现象、红色沉淀、无现象
9.已知A2-离子共含有x个中子,A元素的质量数为m,则n克A2-离子共含有电子的物质的量为( )mol
A.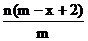 B.
B.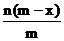 C.
C.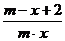 D.
D.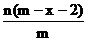
10.若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是
A.生成了一种强酸弱碱盐 B.弱酸溶液和强碱溶液反应
C.强酸溶液和弱碱溶液反应 D.一元强酸溶液和一元强碱溶液反应
11.有三瓶体积相等,浓度都是1mol?L-1的HCl溶液①、②、③,将①加热蒸发至体积减少一半,在②中加入少量CH3OOONa固体(加入后溶液仍呈强酸性),③不作任何改变。然后以酚酞作指示剂,用NaOH溶液滴定上述三种溶液,所消耗NaOH溶液的体积是
A.①=③>② B.②>③>① C.③=②>① D.①=②=③
12.在体积为VmL 密度为ρg/cm3的溶液中,含有式量为M的溶质mg,其物质的量浓度为c mol/L,溶质质量分数为ω% 下列表示式中正确的是
A.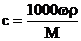 B.
B.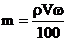 C.
C.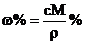 D.
D.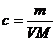
二.选择题(共12小题,每小题3分,计36分。每小题有一个或两个选项正确。全部选对的得3分,选对不全的得1分,有选错或不答的得0分)
13.下列说法中正确的是
A.工业上采用电解熔融的氯化铝制取金属铝
B.所有的离子化合物都是强电解质
C.含1mol NaHCO3的溶液中含NA 个HCO3-
D.H2S和NH3均是价电子总数为8的极性分子
14.已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中,下列排序肯定不正确的是
A.c(OH-)>c(A-)>c(B-)>c(H+) B.c(Na+)>c(B-)>c(OH-)>c(H+)
C.c(Na+)>c(A-)>c(OH-)>c(H+) D.c(OH-)>c(HA)>c(HB)>c(H+)
15.某元素的离子X2+有6个电子层,最外层有2个电子,将XO2溶于浓盐酸时,有黄绿色的气体产生,则下列相关说法正确的是
A.元素X位于周期表第六周期ⅣA族 B.元素X为ⅡA族元素
C.XO2具有强氧化性 D.X2+具有强还原性
16.燃料电池是燃料(如H2、CO、CH4等)跟氧气或空气起反应,将化学能转变为电能的装置,电解质溶液是强碱溶液。下面关于甲烷燃料电池的说法中正确的是
A.负极反应:O2+2H2O+4e-=4OH-
B.负极反应:CH4+10OH--8e-=CO32-+7H2O
C.随着放电的进行,溶液的pH不变
D.放电时溶液中的阴离子向负极移动
17.某溶液中含有两种溶质NaCl和H2SO4,物质的量之比为3∶1。用石墨作电极电解溶液,根据电极产物,可明显分为三个阶段。下列叙述不正确的是
A.阴极只析出H2 B.阳极先析出Cl2,后析出O2
C.电解最后阶段为电解水 D.溶液pH不断增大,最后为7
18.下列反应的离子方程式正确的是
A.常温下Al与浓硝酸反应:Al+6H++3NO3-=Al3++3NO2↑+3H2O
B.向Ca(ClO)2溶液中通入二氧化硫:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
C.小苏打溶于盐酸:CO32-+2H+=CO2↑+H2O
D.硫酸铝溶液和小苏打溶液反应:Al3++3HCO3-=3CO2↑+Al(OH)3↓
19.1mol X气体跟a mol Y气体在体积可变的密闭容器中发生如下反应:X(g)+a Y(g)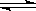 b Z(g)反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是
b Z(g)反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是
A.a=1,b=1 B.a=2,b=
20.在稀H2SO4酸化的H2O2溶液中加入乙醚后液体分层,再加入少量的K2Cr2O7溶液并振荡,在乙醚层中出现蓝色,这是因为反应生成的CrO5溶于乙醚所致,CrO5的结构如下图:上述反应为Cr2O72-+4H2O2+2H+=2CrO5+5H2O,根据以上实验事实分析,下列叙述中正确的是
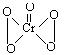 A.Cr2O72-被氧化成CrO5
A.Cr2O72-被氧化成CrO5
B.H2O2被氧化成H2O
C.该反应不属于氧化―还原反应
D.此反应可用于检验Cr2O72-离子
21.有Na2CO3、NaHCO3、CaO和NaOH组成的混合物
A.10.6g B.5.3g C.5.9g D.无法确定
22.在 2SO3(g);△H= ―197kJ/mol,在相同温度和压强下,向一容积可变的密闭容器中通入2molSO2和1molO2,达到平衡时,放热Q1,向另一相同密闭容器中通入1molSO2和0.5molO2,达平衡时放热为Q2,则下列关系正确的是
2SO3(g);△H= ―197kJ/mol,在相同温度和压强下,向一容积可变的密闭容器中通入2molSO2和1molO2,达到平衡时,放热Q1,向另一相同密闭容器中通入1molSO2和0.5molO2,达平衡时放热为Q2,则下列关系正确的是
A.Q1<Q2<197kJ B.Q1=Q2=197kJ
C.2Q2<Q1<197kJ D.2Q2=Q1<197kJ
23.下列变化的实质相似的是
①浓硫酸和浓盐酸在空气中敞口放置时浓度均减小
②二氧化硫和氯气均能使品红溶液褪色
③二氧化硫能使品红溶液、溴水褪色
④氨气和碘化氢气体均不能用浓硫酸干燥
⑤常温下浓硫酸用铁的容器存放、加热条件下浓硫酸能与木炭反应
⑥浓硫酸能在白纸上写字,氢氟酸能在玻璃上刻字
A.只有②③④ B.只有⑤ C.只有③④⑥ D.全部
24.用石墨电极电解含有一定量重水(D2O)的水(H2O),下列说法正确的是
A.相同状况下两电极上产生的气体体积之比为2∶1
B.两电极上产生的气体质量之比为8∶1
C.相同状况下两电极上产生的气体体积之比为4∶1
D.若两电极上产生的气体质量比为16∶3,则D2O与H2O的物质的量之比为1∶1
卷Ⅱ(非选择题 共40分)
三.填空题(共5小题,计40分)
25.(本题3分)已知1molH2完全燃烧生成气态水时放出热量241.8kJ,又知当
26.(本题8分)某反应体系中的物质有: NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
⑴请将Au2O3之外的反应物与生成物分别填入以下空格内并配平。
|