
第五单元 化学方程式
课题1 质量守恒定律
教学目标:
1、 识记:质量守衡定律
2、 理解:从微观角度认识质量守衡定律
3:能用微粒的观点说明质量守恒的本质原因,能用质量守恒定律解释常见化学反应中质量关系。认识定量研究对化学科学发展的意义。
4:通过具体化学反应分析,使学生理解化学方程式的涵义。
重点:质量守恒定律的涵义及应用,正确书写化学方程式。
难点:质量守恒定律的理解及应用,正确书写化学方程式。
教学过程:
本单元内容分为两部分,第一部分“质量守恒定律”从量的方面去研究化学反应的客观规律,为化学方程式的教学作好理论准备,这是学好本单元内容的基础。第二部分“化学方程式”讲了书写化学方程式的原则、方法和步骤,说明化学方程式表示的意义,这是本单元的中心。
一:质量守定律
展示化学反应实例为学生创设情境。引出化学反应前后物质的质量总和有何变化。
教师引导学生回答怎样设计实验来检验自己的猜想。
教师演示实验:白磷燃烧设疑:(1)观察到哪些现象?
(2)分析结果思考:反应中玻璃管上端没有系小气球,将会出现什么结果?
指导学生动手实验,并设疑:反应前后物质总质量有何关系?通过实验分析得出结论。(1)观察到哪些现象?
(2)记录反应前后物质总质量;
(3)分析结果。指导学生分析讨论:以碳在氧气中燃烧生成二氧化碳为例,从化学反应中分子、原子的变化情况说明化学反应必定符合质量守恒定律。教师通过微观模拟讲解化学反应前后原子的种类、数目、都没有变化。
分组学生实验:
1、铁钉与硫酸铜溶液反应;
2、蜡烛燃烧
根据实验结果分析化学反应前后物质的质量总和相等
讲解化学方程式的书写方法及化学议程式所表明的涵义指导学生讨论:下列反应的化学方程式能提供给你哪些信
根据实验结果分析化学反应前后物质的质量总和相等
实验方案
实验方案1
实验方案2
实验
反应前总质量
反应后总质量
分析
学生讨论得出结论:化学反应前后原子的种类没有改变,数目没有增减,质量也没有改变。
教材在从实验的结果归纳出质量守恒定律后,接着就提出“为什么物质在发生化学反应前后,各物质的质量总和相等呢?”提出这个问题的目的,在于要引导学生从化学反应的实质上去认识质量守恒定律。在化学反应中,只是由于发生了原子间的重新组合,才使反应物变成生成物,但在这一变化中,原子的种类和个数并没有发生变化,原子的质量也没有发生变化,所以,反应前和反应后各物质的质量总和必然相等。应该注意,对质量守恒定律的本质分析,要明确落到化学反应前后原子的种类和个数保持不变这一关键点上,这不仅有利于理解质量守恒定律的本质,而且为学习化学方程式准备了基础知识
【小结板书】参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和,这个规律叫做质量守恒定律。(此定律为重要概念可让学生在1~2min内熟练背诵下来。)
〔设疑〕为什么物质在发生化学反应前后质量总是相等呢?
〔阅读〕见教材有关内容,学生阅读讨论后回答。
〔板书〕在一切化学反应中,反应前后原子的种类没有改变,原子的数目没有增减.原子的质量也没有变比。所以,化学反应前后各物质的质量总和必然相等。
〔巩固练习〕1.试解释镁条在空气中燃烧后,固体的质量增加了。
2.蜡烛燃烧后质量是否变化?是否遵守质量守恒定律?
二:化学方程式
化学方程式是初中化学入门的三种重要化学用语,掌握了它们才有可能学好化学,其重要性可想而知。学生已经学习了元素符号、化学式、化学反应的实质,知道了一些化学反应和它们的文字表达式,结合刚学习了质量守恒定律,已经完全具备了学习化学方程式的基础
教材根据质量守恒定律,导出了化学方程式的概念,即用物质的化学式表示化学反应的式子叫化学方程式。通过木炭在氧气中燃烧这个实例,用简炼的文字准确叙述了化学方程式的意义:(1)表示了化学反应物和生成物。(2)表明了该化学反应进行的条件。(3)表示了各物质之间的质量关系,即各物质之间的质量比。
【复习提问】1.什么是质量守恒定律?2.为什么在化学反应前后,各物质的质量总和必然是相等的呢?(用原子、分子的观点说明。)
〔引言〕我们已经知道质量守恒定律,那么在化学上有没有一种式子,既能表示出反应物和生成物是什么,又能反映出遵循质量守恒定律呢?回答是肯定的,这就是化学方程式。
板书〕化学方程式
化学方程式:用化学式来表示化学反应的式子。
例如:木炭在氧气中充分燃烧的化学方程式为:C + O2
 CO2
CO2
12∶ 16×2 ∶ 12+16×2
(指出化学方程式质和量的意义。) 12 ∶ 32 ∶ 44
化学方程式能客观地反映出化学反应中“质”和“量”的变化及关系。所以化学方程式的读法不同于数学方程式。化学方程式中的“+”号应读成“和”,不能读成“加”;反应物和生成物中间的“==”号,应读成“生成”,不能读成“等于”。
H2 + CuO 加热 Cu + H2O
Mg+CuO加热MgO+Cu
化学方程式可读出质的变化,也可读出量的变化。每个方程式都有三种读法
现以2H2O 2H2↑+O2↑为例说明。
2H2↑+O2↑为例说明。
(一)物质读法
上式读作“在通电的条件下,水分解生成氢气和氧气”,这种读法说明了化学反应中物质的变化。
(二)粒子读法
上式读作“在通电条件下,每2个水分子分解生成2个氢分子和1个氧分子”。这种读法揭示了化学反应中结构微粒的变化,并反映出微粒个数的比例关系。
(三)数量读法
上式读作“通电时,36份质量的水分解生成4份质量的氢气和32份质量的氧气”,这种读法表明了化学反应中物质的数量关系。
化学方程式跟数学方程有何不同?
数学上的方程式,仅是表示等号两边的数目相等。等号两边各项可以移项或倒写。而化学方程式可以:
(l)表示反应物是什么,生成物是什么。
(2)表示各种反应物的总质量等于各种生成物的总质量(质量守恒)。
(3)表示反应物与生成物的原子、分子个数比。
(4)表示反应物和生成物的质量比。 化学方程式是不能倒写和移项的,如,不能将3Fe+2O2 Fe3O4写成 Fe3O4
Fe3O4写成 Fe3O4 3Fe+2O2,也不能写成3Fe
3Fe+2O2,也不能写成3Fe Fe3O4-2O2。
Fe3O4-2O2。
至于化学方程式中的“+”和“=”号虽与数学中的“+”和“=”号在形式上一样,但其意义却不相同。化学方程式中的“+”,在读时不读“加”而是读“和”。化学方程式中的“等号”表示“生成”的意思,同时表明在化学反应前后有两个不变:原子种类不变;每种原子的总个数也不变。“=”读作“反应生成”而不能读“等于”。
课题2 如何正确书写化学方程式
教学目标:
1:理解化学方程式书写原则
2:学会化学方程式的简单配平
重点:重点是正确书写化学方程式
难点:难点是化学方程式的配平方法
教学过程:
化学方程式的书写是本单元的一个重点内容。在讲解书写化学方程式要遵守两个原则时,教材强调指出:不能随意臆造事实上不存在的物质和化学反应,不能任意编造物质的化学式。教材以磷在空气中燃烧生成五氧化二磷的反应为例,说明书写化学方程式的三个步骤:
(1)依据实验事实,把反应物的化学式写在左边,生成物的化学式写在右边,反应物与生成物之间用一条短线相连
(2):根据质量守恒定律,在反应物、生成物的化学式前配上适当的系数,使式子左、右两边的每一种元素的原子总数相等,这个过程叫化学方程式的配平。
(3):要在化学方程式中注明反应发生的基本条件,用“↓”表示生成物中的沉淀,用“↑”表示生成物中的气体。在上述三个步骤中,以化学方程式的配平最为关键,
教材始终以质量守恒定律作为理论指导,化学方程配平,就是要使完成的化学方程式符合质量守恒定律,而且在最后还要求教师组织学生讨论“为什么说质量守恒定律是书写化学方程式的理论基础?”来加以强化。
此外,教材还介绍了用最小公倍数法配平化学方程式。最小公倍数法是一种比较简单和常用的配平方法,应当在课堂上适当组织练习,使学生初步学会这种配平方法。本单元教材的特点是:通过对多种化学实验的观察和思考,得出质量守恒定律,再把质量守恒定律运用于化学反应,配平化学方程式,并初步涉及到定量研究化学反应的科学方法
以磷在空气中燃烧生成五氧化二磷的反应为例,说明书写化学方程式的具体步骤。
〔板书〕1.根据实验事实写出反应物及生成物的化学式 P+O2─P2O5
2.配平化学方程式 用最小公倍数法确定系数。(根据是质量守恒守律)。把短线改等号。
4P+5O2===2P2O5
3.注明反应发生的条件4P+5O2点燃2P2O5
(介绍“△”’“↑”“↓”等符号表示的意义,及“↑”“↓”符号的使用范围)。
〔讲解〕反应条件常见的有:点燃、加热(△)、高温、催化剂等。
“↑”“↓”号的使用范围:在反应物中无气态物质参加反应,如果生成物中有气体,则在气体物质的化学式右边要注“↑”号;在溶液中进行的化学反应,反应物无难溶性物质参加反应,如果生成物中有固体难溶性物质生成,在固体物质的化学式右边要注“↓”号。(强调要防止随意乱标)
对初中化学实验教科书所说的“如果生成物有沉淀或者气体产生,一般应该用“↓”号或者“↑”号表示出来,”理解不深。教师在教学中应强调“生成物”三个字。例二说明学生对酸、碱、盐的溶解性不熟悉,分不清哪些是易溶物质,哪些是难溶物质。教师应加强对酸、碱、盐溶解性表的教学,编成“口诀”,使学生背熟记牢。例三、例四都存在着“↓”、“↑”号书写不规范的问题,教师在教学中应严格要求学生规范化。
(1)
书写一般的化学反应方程式,包括化合、分解、置换和复分解反应。如果反应物和生成物均为气态物质,可不用“↑”号表示生成物。 〔板书〕例如:H2+Cl2 2HCl 2SO2+O2
2HCl 2SO2+O2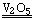 2SO3
2SO3
其中氯化氢和三氧化硫气体可以不用“↑”表示。
(2)非水体系不用“↓”例:H2S=H2↑+S 2Cu(NO3)2 2CuO+4NO2↑+O2↑ 其中S和CuO不用“↓”号表示。
2CuO+4NO2↑+O2↑ 其中S和CuO不用“↓”号表示。
(一)要以事实为依据,不能臆造。例如有学生将铁丝在氧气里燃烧的化学方程式写为:4Fe+3O2 2Fe2O3是错误的,因为他违背了铁丝在氧气里燃烧生成的是四氧化三铁这一事实。
2Fe2O3是错误的,因为他违背了铁丝在氧气里燃烧生成的是四氧化三铁这一事实。
(二)要分清反应物和生成物,不能将反应物和生成物“调位”。例如有学生将2H2+O2 H2O,写成2H2O==2H2+O2是错误的,前者反应物是氢气和氧气,表示氢气在氧气里燃燃生成水的一个化合反应;后者反应物则是水,表示水在一定条件下反应生成氢气和氧气的一个分解反应,两式所表示的意义是不同的。
H2O,写成2H2O==2H2+O2是错误的,前者反应物是氢气和氧气,表示氢气在氧气里燃燃生成水的一个化合反应;后者反应物则是水,表示水在一定条件下反应生成氢气和氧气的一个分解反应,两式所表示的意义是不同的。
(一)要遵循质量守恒定律,不能忘记配平。初学化学的人常易忘记配平,没有配平就不能反映化学反应中“质量守恒”这一事实,不能称为化学方程式。配平时,只能调整式子左右两边化学式前的系数,而不能改动化学式中元素符号右下角的小数字。如P2+5O=P2O5,2P+O5=P2O5等等都是错误的。
(四)要正确使用“↑“↓“Δ”等符号,不能忽视反应条件,许多化学反应在特定条件下才能进行,书写化学方程式时,要在等号上标明反应条件,未标明反应条件的化学方程式不是一个完整的化学方程式。有的还应用“↑”“↓”来标明生成物的状态,指生成了气体、沉淀。如用氯酸钾制取氧气的化学方程式应写成:2KClO3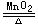 2KCl+3O2↑值得注意的是,只有当反应物为固态或液态物质、生成物中有气态物质时,一般才可用“↑”标明。“Δ”符号表示加热而不是点燃。
2KCl+3O2↑值得注意的是,只有当反应物为固态或液态物质、生成物中有气态物质时,一般才可用“↑”标明。“Δ”符号表示加热而不是点燃。
课题3 利用化学方程式的简单计算
教学目标、1:使学生掌握利用化学方程式进行计算的步骤和方法。
2、通过化学议程式的计算提高学生分析问题、解决问题的能力。
3:在理解化学方程式的基础上,使学生掌握有关的反应物、生成物的计算能力:掌握解题格式和钥匙方法,培养学生钥匙能力。思想教育:从定量的角度理解化学反应,了解根据化 学方程式的计算在工、农业生产和科学实验中的意义,学会科学地利用能源。
重点:1:由一种反应物(或生成物)的质量求生成物(或反应物)的质量
2:利用化学方程式计算的步骤。
难点:1:根据化学方程式进行计算的方法。
2:物质之间量的关系。
教学过程:
完成下列各化学反应方程式,并求出有关物质之间的质量比。
1过氧化氢与二氧化锰混合,写出反应物及生成物之间的质量比。
2碳在氧气中燃烧,碳与氧气的质量比。
3氢气还原氧化铜,氧化铜与水的质量比。
4锌与盐酸反应,氯化锌与氢气的质量比。
二、 导入新课:
由于化学方程式反映出各物质的质量比,因此,我们可以根据化学方程式进行有关计算。进行计算时必须知道一种物质的质量,由此可以求出其它物质的质量。那么,怎样根据化学方程式计算呢?
1:分组加热3g和6g的高锰酸钾,测出生成氧气的质量,找出高锰酸钾与氧气之间的关系。
若制取氧气袋中的氧气质量是20克,让学生计算需要高锰酸钾的质量。
思考)例题1中所发生的反应的化学方程式怎么写?
本题中已知质量的物质是谁?待求质量的物质是谁?
三、 新授部分:利用化学方程式的简单计算
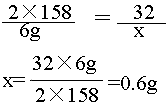 解](1)设未知量 设:加热分解6g高锰酸钾可以得到氧气的质量为x。
解](1)设未知量 设:加热分解6g高锰酸钾可以得到氧气的质量为x。
(2)写出反应的化学方程式并配平2KMnO4 加热 K2MnO4 + MnO2
+ O2↑
(3)写出相关物质的相对分子的 2X158 ??? 32
质量和已知量、未知量 6g
??? x
4)列出比例式,求解
????????????????
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com