
科目:gzhx 来源: 题型:阅读理解
(1)氨基酸是蛋白质的基石,氨基酸分子中的氨基(―NH2)显碱性。氨基酸往往形成一种两性离子,在水溶液中存在如下平衡:
![]()
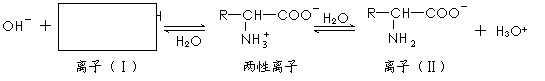 。
。
方框内所表示的离子(Ⅰ)的结构简式是 。
![]() (2)谷氨酸的一钠盐(
(2)谷氨酸的一钠盐(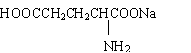 )是味精的主要成分。当前我国生产味精主要采用淀粉发酵法,其中第一步是使淀粉水解为单糖。
)是味精的主要成分。当前我国生产味精主要采用淀粉发酵法,其中第一步是使淀粉水解为单糖。
实验室中检验淀粉水解产物应选用的试剂是 (填字母)。
A.NaOH溶液、氨水、AgNO3溶液 B.H2SO4溶液、氨水、AgNO3溶液
C.NaOH溶液、CuSO4溶液 D.H2SO4溶液、CuSO4溶液
(3)“沙伦逊甲醛滴定法”用于测定味精中谷氨酸一钠盐的含量。将一定质量味精样品溶于水,再向溶液中加入36%甲醛溶液,反应为 ―NH2 + HCHO → ―N=CH2 + H2O,再以酚酞为指示剂,用NaOH溶液进行滴定。上述测定过程中加入甲醛的目的是 。
(4)味精中常含食盐,两同学分别设计甲、乙两种方案测定味精中NaCl的含量。
①甲方案:取一定质量味精样品溶于水,加入足量稀硝酸酸化的硝酸银溶液,充分反应后,过滤、 (填缺少的步骤),称量沉淀质量,重复实验3次。
②乙方案:已知AgSCN是难溶于水的沉淀。取m g味精溶于水,加入过量浓度为c1 mol・L-1的AgNO3溶液,再加入少量 (填可能的化学式)溶液作指示剂,用浓度为c2 mol・L-1的NH4SCN溶液进行滴定,当溶液变为红色时,达到滴定终点。设测定过程中所消耗的AgNO3溶液和NH4SCN溶液的体积分别为V1 mL和V2 mL,则该味精样品中NaCl的质量分数是?
科目:gzhx 来源: 题型:
有甲、乙两种氨水,甲中 H2SO4 的质量分数为 3a %,乙中氨水的质量分数为 a %,取甲、乙两溶液等体积混合,搅拌均匀后所得氨水中溶质的质量分数( )
A.>2a% B.<2a% C.=2a% D.无法确定
科目:gzhx 来源: 题型:
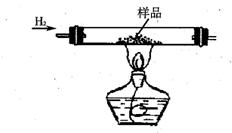 实验室有CuO和铜粉的混合物.要测定该样品(已称得其质量为m g)中氧化铜的质量分数.
实验室有CuO和铜粉的混合物.要测定该样品(已称得其质量为m g)中氧化铜的质量分数.| 实验方法 | 有关化学方程式 | 实验用仪器(填序号) | 实验需直接测定的物理量(用文字说明) |
| (1) | H2SO4+CuO═CuSO4+H2O | ||
| (2) | 实验前坩埚与样品总质量(或坩埚质量)、实验后坩埚与CuO总质量 |
科目:gzhx 来源: 题型:
 Ⅰ.甲、乙两种元素是同一短周期的相邻元素,乙元素的原子是同周期元素中未成对p电子数最多的,甲元素有多种同素异形体,其中一种能导电.
Ⅰ.甲、乙两种元素是同一短周期的相邻元素,乙元素的原子是同周期元素中未成对p电子数最多的,甲元素有多种同素异形体,其中一种能导电.科目:gzhx 来源:2011年广东省湛江二中高考化学四模试卷(解析版) 题型:解答题

科目:gzhx 来源:学习周报 化学 人教课标高一版(必修1) 2009-2010学年 第19~26期 总第175~182期 人教课标版 题型:013
|
某同学仿照“喷泉”实验的原理,在实验室做了一个“喷烟”实验,如图所示.他在甲、乙两个烧瓶中分别充入 X、Y两种无色气体,在胶头滴管中盛有少量水,实验开始时将胶头滴管内的液体挤入甲烧瓶内,然后打开止水夹,便可看到甲烧瓶的导管口喷出烟.已知X、Y是HCl、NH3、Cl2、O2、SO2、NO六种气体中的两种,下列判断中正确的是
| |
| [ ] | |
A. |
X可能是NH3,Y可能是HCl |
B. |
X可能是Cl2,Y可能是HCl |
C. |
X可能是SO2,Y可能是O2 |
D. |
X可能是NO,Y可能是O2 |
科目:gzhx 来源: 题型:
有甲、乙两种 H2SO4(aq),甲中 H2SO4 的质量分数为 3a %,乙中 H2SO4 的质量分数为 a %,取甲、乙两溶液等体积混合,搅拌均匀后所得 H2SO4(aq) 中溶质的质量分数( )
A.>2a% B.<2a% C.=2a% D.无法确定
科目:gzhx 来源: 题型:

科目:gzhx 来源: 题型:

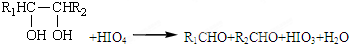
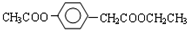

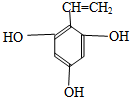
| 500~600℃ |
| 500~600℃ |
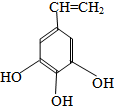 、
、
 、
、
科目:gzhx 来源: 题型:阅读理解

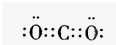
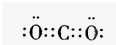
科目:gzhx 来源: 题型:
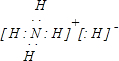
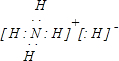
科目:gzhx 来源: 题型:
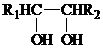 +HIO4→R1CHO+R2CHO+HIO3+H2O
+HIO4→R1CHO+R2CHO+HIO3+H2O

| 500~600℃ |
| 500~600℃ |
| △ |
| △ |
 、
、
 、
、
科目:gzhx 来源:2010年湖北省武汉市师大一附中高三五月适应性考试理综化学试题 题型:选择题
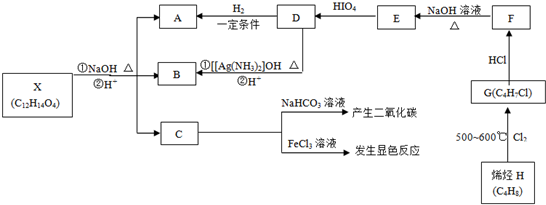
(16分).有机物X、A、B、C、D、E、F、G、H可以发生如下转化。其中C苯环上的一氯代物只有两种,烯烃H与HCl加成生成的产物有两种,D分子中所有的原子不可能均处在同一平面内。

回答下列问题:
(1)C中含氧官能团的名称____________;
(2)写出下列物质的结构简式:
D____________、X____________;
(3)写出下列化学反应方程式及反应类型
①H G:____________;反应类型:______
G:____________;反应类型:______
②F E:____________;反应类型:______
E:____________;反应类型:______
(4)C的另一种同分异构体甲满足以下条件:
①属于芳香族化合物;②苯环上的一氯取代物只有一种;③与足量的NaOH溶液完全反应1 mol甲消耗3 mol NaOH。写出甲所有的结构简式:_________________。
科目:gzhx 来源: 题型:
(16分).有机物X、A、B、C、D、E、F、G、H可以发生如下转化。其中C苯环上的一氯代物只有两种,烯烃H与HCl加成生成的产物有两种,D分子中所有的原子不可能均处在同一平面内。
回答下列问题:
(1)C中含氧官能团的名称____________;
(2)写出下列物质的结构简式:
D____________、X____________;
(3)写出下列化学反应方程式及反应类型
①H![]() G:____________;反应类型:______
G:____________;反应类型:______
②F![]() E:____________;反应类型:______
E:____________;反应类型:______
(4)C的另一种同分异构体甲满足以下条件:
①属于芳香族化合物;②苯环上的一氯取代物只有一种;③与足量的NaOH溶液完全反应1 mol甲消耗3 mol NaOH。写出甲所有的结构简式:_________________。
科目:gzhx 来源:2010-2011学年浙江省温州市高三五校联考化学试卷 题型:实验题
四种短周期元素A、B、C、D的性质或结构信息如下:
信息① 原子半径大小:A>B>C>D
信息② 四种元素之间形成的某三种分子的比例模型及部分性质:

请根据上述信息回答下列问题。
(1)B元素在周期表中的位置 ,请写出BC2分子的电子式 。
(2)A所在周期中,E元素的单质还原性最强,F元素的某些盐类常用作净水剂。E单质与甲反应有化合物X生成。请写出以下两个反应的离子方程式。
①A元素的单质与物质甲发生的反应 。
②F、C两种元素组成的化合物Y可作为高温结构陶瓷材料,X与Y两种化合物在溶液中发生的反应 。
(3)物质丁的元素组成和甲相同,丁分子具有18电子结构。向盛有一定浓度丁溶液的试管中,逐滴加入用少量稀硫酸酸化的硫酸亚铁溶液。滴加过程中的现象是:
①浅绿色溶液变成深棕黄色,②有少量气泡出现(经验证是氧气),片刻后反应变得剧烈,并放出较多热量,继续滴加溶液,静置一段时间,③试管中出现红褐色。向其中再滴入稀硫酸,红褐色变为黄色。请用化学方程式或离子方程式①、②、③中加点的字。
① ② ③ 。
科目:gzhx 来源: 题型:
四种短周期元素A、B、C、D的性质或结构信息如下:
信息① 原子半径大小:A>B>C>D
信息② 四种元素之间形成的某三种分子的比例模型及部分性质:

请根据上述信息回答下列问题。
(1)B元素在周期表中的位置 ,请写出BC2分子的电子式 。
(2)A所在周期中,E元素的单质还原性最强,F元素的某些盐类常用作净水剂。E单质与甲反应有化合物X生成。请写出以下两个反应的离子方程式。
①A元素的单质与物质甲发生的反应 。
②F、C两种元素组成的化合物Y可作为高温结构陶瓷材料,X与Y两种化合物在溶液中发生的反应 。
(3)物质丁的元素组成和甲相同,丁分子具有18电子结构。向盛有一定浓度丁溶液的试管中,逐滴加入用少量稀硫酸酸化的硫酸亚铁溶液。滴加过程中的现象是:
①浅绿色溶液变成深棕黄色,②有少量气泡出现(经验证是氧气),片刻后反应变得剧烈,并放出较多热量,继续滴加溶液,静置一段时间,③试管底部出现红褐色沉淀。向浊液中再滴入稀硫酸,沉淀溶解,溶液呈黄色。请用化学方程式或离子方程式及必要的文字解释①、②、③中加点的字。① ② ③ 。
科目:gzhx 来源: 题型:
四种短周期元素A、B、C、D的性质或结构信息如下:
信息① 原子半径大小:A>B>C>D
信息② 四种元素之间形成的某三种分子的比例模型及部分性质:
请根据上述信息回答下列问题。
(1)B元素在周期表中的位置 ,请写出BC2分子的电子式 。
(2)A所在周期中,E元素的单质还原性最强,F元素的某些盐类常用作净水剂。E单质与甲反应有化合物X生成。请写出以下两个反应的离子方程式。
①A元素的单质与物质甲发生的反应 。
②F、C两种元素组成的化合物Y可作为高温结构陶瓷材料,X与Y两种化合物在溶液中发生的反应 。
(3)物质丁的元素组成和甲相同,丁分子具有18电子结构。向盛有一定浓度丁溶液的试管中,逐滴加入用少量稀硫酸酸化的硫酸亚铁溶液。滴加过程中的现象是:
①浅绿色溶液变成深棕黄色,②有少量气泡出现(经验证是氧气),片刻后反应变得剧烈,并放出较多热量,继续滴加溶液,静置一段时间,③试管中出现红褐色。向其中再滴入稀硫酸,红褐色变为黄色。请用化学方程式或离子方程式①、②、③中加点的字。
① ② ③ 。
科目:gzhx 来源:2014届浙江省高一上学期第一次月考化学试卷(解析版) 题型:填空题
(12分)元素X、Y、Z、M、Q均为短周期主族元素,且原子序数依次增大。已知元素Y最高价氧化物对应水化物与它的氢化物反应能生成一种盐;Z原子最外层电子数与核外电子总数之比为3:4;M可与Z形成阴、阳离子个数比为1:2的两种化合物,Q原子的最外层电子数与次外电子数之比为3:4,YX3常温下为气体。
(1)化合物A、B由X、Z、M、Q四种元素中的三种组成的强电解质,且A属于碱,B属于盐,组成元素的原子数目之比均为1:1:1,则化合物A的化学式为 ,B的化学式是 。
(2)Se是人体必备的微量元素,与Q同一主族。该族二至五周期元素单质分别与H2反应生成1mol 气态氢化物的反应热如下,表示生成1 mol哂化氢反应热(△H)的是 (填字母代号)。
A.+99.7kJ·mol-1 B.+29.7 kJ·mol-1
C.-20.6 kJ·mol-1 D.-241.8 kJ·mol-1
(3)X与Z、X与Q均可形成18电子分子甲和乙,写出甲、乙两种分子在水溶液中反
应生成Q单质的化学方程式 。X和Y也可形成18电子分子丙,它通常是一种液态火箭燃料。25℃、常压下,3.2g丙在氧气中完全燃烧放出热量为62.4kJ,请写出丙完全燃烧的热化学反应方程式 。
(4)X、Y两种元素形成的离子化合物的电子式为 。
科目:gzhx 来源:2011-2012学年浙江省嵊泗中学高一上学期第一次月考化学试卷(带解析) 题型:填空题
(12分)元素X、Y、Z、M、Q均为短周期主族元素,且原子序数依次增大。已知元素Y最高价氧化物对应水化物与它的氢化物反应能生成一种盐;Z原子最外层电子数与核外电子总数之比为3:4;M可与Z形成阴、阳离子个数比为1:2的两种化合物,Q原子的最外层电子数与次外电子数之比为3:4,YX3常温下为气体。
(1)化合物A、B由X、Z、M、Q四种元素中的三种组成的强电解质,且A属于碱,B属于盐,组成元素的原子数目之比均为1:1:1,则化合物A的化学式为 ,B的化学式是 。
(2)Se是人体必备的微量元素,与Q同一主族。该族二至五周期元素单质分别与H2反应生成1mol 气态氢化物的反应热如下,表示生成1 mol哂化氢反应热(△H)的是 (填字母代号)。
A.+99.7kJ·mol-1 B.+29.7 kJ·mol-1
C.-20.6 kJ·mol-1 D.-241.8 kJ·mol-1
(3)X与Z、X与Q均可形成18电子分子甲和乙,写出甲、乙两种分子在水溶液中反
应生成Q单质的化学方程式 。X和Y也可形成18电子分子丙,它通常是一种液态火箭燃料。25℃、常压下,3.2g丙在氧气中完全燃烧放出热量为62.4kJ,请写出丙完全燃烧的热化学反应方程式 。
(4)X、Y两种元素形成的离子化合物的电子式为 。