
科目:gzhx 来源: 题型:
A.5.4 Kj B.350 kJ C.3.5 kJ D.8.5 kJ
科目:gzhx 来源: 题型:
| A、该反应的化学能可以转化为电能 | B、反应物的总能量高于生成物的总能量 | C、上述热化学方程式中的△H的值与反应物的用量无关 | D、该反应为放热反应,所以反应物的总键能大于生成物的总键能 |
科目:gzhx 来源: 题型:
| A、反应物的总能量高于生成物的总能量 | B、上述热化学方程式中的△H的值与反应物的用量无关 | C、该反应的化学能可以转化为电能 | D、该反应中旧键断裂吸收能量,新键形成放出能量,所以物质的总能量不变 |
科目:gzhx 来源:浙江省诸暨中学2011-2012学年高二上学期期中考试化学试题(实验班) 题型:058
“白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一.镀锌层犹如铁皮的保护层,这层膜的厚度及均匀度也成了判断镀层质量的重要指标.某研究性学习小组为了测定镀锌铁皮的厚度,设计了下面的实验方案:
方案一:取三块镀锌铁皮(A、B、C,截自同一块镀锌铁皮),将镀锌铁皮A放入烧杯中,加入40 mL 6 mol·L
-1盐酸,反应时用玻璃棒小心翻动镀锌铁皮,待锌镀层反应完全时,立即将未反应的铁皮取出,洗涤、小心烘干、称量.将B、C重复上面的实验.(1)锌镀层完全反应的标志是________.
(2)如何检验铁片已经洗净________.
方案二:已知锌与强碱溶液反应的离子方程式为:Zn+2OH-+2H2O=[Zn(OH)4]2-+H2↑.某同学按下图装置设计了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为S cm2、质量为m g的镀锌铁皮放入6 mol·L-1 NaOH溶液中.回答下列问题:

(3)装置中导管a的作用是________.
(4)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:
①记录C的液面位置;②待B中不再有气体产生并恢复至室温;③由A向B中滴加足量NaOH溶液;④上下移动C,使干燥管和C中液面相平.
上述操作的顺序是________(填序号).
(5)实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL(已知Zn的密度为7.14 g/cm3,实验条件的气体摩尔体积为Vm L/mol).则镀锌铁皮的镀层厚度为________cm.(写出数学表达式)
科目:gzhx 来源:2013年安徽省合肥市高考化学一模试卷(解析版) 题型:选择题
科目:gzhx 来源:合肥一模 题型:单选题
| A.该反应的△H值与反应物用量无关 |
| B.该反应的化学能可以转化为电能 |
| C.反应物的总能量高于生成物的总能量 |
| D.该反应中反应物的化学键断裂放出能量,生成物化学键形成吸收能量 |
科目:gzhx 来源: 题型:阅读理解
| 1 |
| 2 |
| 1 |
| 2 |
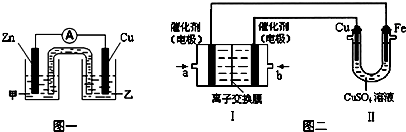
科目:gzhx 来源: 题型:阅读理解
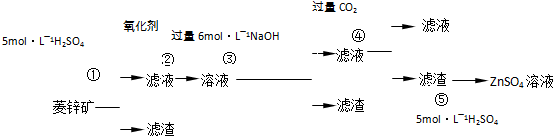
| 煅烧还原 |
| 水浸取 |
| 过滤 |
科目:gzhx 来源:2010年广东省高二上学期期中考试化学卷 题型:选择题
已知:(1)Zn(s)+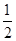 O2(g)=== ZnO(s),ΔH1= -348.3 kJ·mol-1,
O2(g)=== ZnO(s),ΔH1= -348.3 kJ·mol-1,
(2)2Ag(s)+ 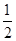 O2(g)=== Ag2O(s),ΔH2=-31.0 kJ·mol-1,
O2(g)=== Ag2O(s),ΔH2=-31.0 kJ·mol-1,
则Zn(s)+ Ag2O(s) === ZnO(s)+ 2Ag(s)的ΔH等于( )
A.-379.3 kJ·mol-1 B.-317.3 kJ·mol-1
C.-332.8 kJ·mol-1 D.317.3 kJ·mol-1
科目:gzhx 来源:2010年广东省东莞市光明、常平、厚街、万江四校高二上学期期中考试化学试卷 题型:选择题
已知:(1)Zn(s)+ O2(g)=== ZnO(s),ΔH= -348.3 kJ·mol-1,
O2(g)=== ZnO(s),ΔH= -348.3 kJ·mol-1,
(2)2Ag(s)+  O2(g)=== Ag2O(s),ΔH= -31.0 kJ·mol-1,
O2(g)=== Ag2O(s),ΔH= -31.0 kJ·mol-1,
则Zn(s)+ Ag2O(s) === ZnO(s)+ 2Ag(s)的ΔH等于( )
A.-379.3 kJ·mol-1 B.-317.3 kJ·mol-1
C.-332.8 kJ·mol-1 D.317.3 kJ·mol-1
科目:gzhx 来源:2013-2014学年湖南省衡阳市高三上学期第三次月考化学试卷(解析版) 题型:选择题
已知下列热化学方程式,则③中的Q3值为
Zn(s)+ O2(g)= ZnO (s) △H= - Q1 kJ• mol-1
①
O2(g)= ZnO (s) △H= - Q1 kJ• mol-1
①
Hg(l) + O2(g)= HgO (s) △H= -Q2 kJ• mol-1
②
O2(g)= HgO (s) △H= -Q2 kJ• mol-1
②
Zn(s) +HgO (s) = Hg(l)+ ZnO (s) △H= -Q3 kJ• mol-1 ③
A.Q2 -Q1 B.Q1 +Q2 C.Q1- Q2 D.-Q1- Q2
科目:gzhx 来源: 题型:
已知下列热化学方程式:
Zn(s) + 1/2 O2(g)= ZnO(s) ΔH = -351.1 kJ·mol-1
Hg(l) + 1/2 O2(g)= HgO(s) ΔH = -90.7 kJ·mol-1
由此可知Zn(s)+ HgO(s)= ZnO(s)+ Hg(l)的反应热ΔH为
A.-260.4 kJ·mol-1 B.+260.4kJ·mol-1 C.- 441.8 kJ·mol-1 D.+ 441.8kJ·mol-1
科目:gzhx 来源: 题型:
已知:(1)Zn(s)+![]() O2(g)=== ZnO(s),ΔH= -348.3 kJ·mol-1,
O2(g)=== ZnO(s),ΔH= -348.3 kJ·mol-1,
(2)2Ag(s)+ ![]() O2(g)=== Ag2O(s),ΔH= -31.0 kJ·mol-1,
O2(g)=== Ag2O(s),ΔH= -31.0 kJ·mol-1,
则Zn(s)+ Ag2O(s) === ZnO(s)+ 2Ag(s)的ΔH等于( )
A.-379.3 kJ·mol-1 B.-317.3 kJ·mol-1
C.-332.8 kJ·mol-1 D.317.3 kJ·mol-1
科目:gzhx 来源:2014届江苏省高二10月阶段练习化学试卷(解析版) 题型:选择题
已知:2Zn(s) + O2(g)= 2ZnO(s) △H1= -701.0kJ·mol-1
2Hg(l)+ O2(g)= 2HgO(s) △H2= -181.6kJ·mol-1
则反应Zn(s) + HgO(s)= ZnO(s) + Hg(l)的△H为
A.+519.4 kJ·mol-1 B.+259.7 kJ·mol-1
C.-259.7 kJ·mol-1 D.-519.4 kJ·mol-
科目:gzhx 来源:2013届浙江省高二上学期期末化学试卷 题型:选择题
.已知:2Zn(s)+O2(g)=2ZnO(s) △H=-701.0kJ·mol-1
2Hg(l)+O2(g)=2HgO(s) △H=-181.6kJ·mol-1
则反应Zn(s)+ HgO(s)=ZnO(s)+ Hg(l)的△H为
A. +519.4kJ·mol-1 B. +259.7 kJ·mol-1 C. -259.7 kJ·mol-1 D. -519.4kJ·mol-1
科目:gzhx 来源:2012-2013学年江苏泰州二中高二上学期期中考试化学(选修)试卷(带解析) 题型:单选题
已知:2Zn(s)+O2(g)=2ZnO(s) ΔH=-701.0kJ·mol-1
2Hg(l)+O2(g)=2HgO(s) ΔH=-181.6kJ·mol-1
则反应Zn(s)+ HgO(s)=" ZnO(s)+" Hg(l)的ΔH为
| A.+519.4kJ·mol-1 | B.+259.7 kJ·mol-1 | C.-259. 7 kJ·mol-1 | D.-519.4kJ·mol-1 |
科目:gzhx 来源:2014届辽宁省高一下学期期中考试化学试卷(解析版) 题型:选择题
已知下列热化学方程式:
Zn(s) + 1/2 O2(g)= ZnO(s) ΔH = -351.1 kJ·mol-1
Hg(l) + 1/2 O2(g)= HgO(s) ΔH = -90.7 kJ·mol-1
由此可知Zn(s)+ HgO(s)= ZnO(s)+ Hg(l)的反应热ΔH为
A.-260.4 kJ·mol-1 B.+260.4 kJ·mol-1 C.- 441.8 kJ·mol-1 D.+ 441.8 kJ·mol-1