
科目:gzhx 来源:2010-2011学年黑龙江省高三上学期期末考试化学试卷 题型:选择题
将16gFeS与FeO的混合物,投入到1L1mol/L的硝酸溶液中充分反应,只产生1/3molNO气体,得到澄清的混合溶液。下列计算结果正确的是
A.混合物中含有0.5molFeS B.混合物中含有0.1mol FeO
C.参加反应的HNO3为1mol D.氧化产物Fe3+为0.15mol
科目:gzhx 来源: 题型:
将16gFeS与FeO的混合物,投入到1L1mol/L的硝酸溶液中充分反应,只产生1/3molNO气体,得到澄清的混合溶液。下列计算结果正确的是
A.混合物中含有0.5molFeS B.混合物中含有0.1mol FeO
C.参加反应的HNO3为1mol D.氧化产物Fe3+为0.15mol
科目:gzhx 来源:2011届黑龙江省大庆实验中学高三上学期期末考试化学试卷 题型:单选题
将16gFeS与FeO的混合物,投入到1L1mol/L的硝酸溶液中充分反应,只产生1/3molNO气体,得到澄清的混合溶液。下列计算结果正确的是
| A.混合物中含有0.5molFeS | B.混合物中含有0.1mol FeO |
| C.参加反应的HNO3为1mol | D.氧化产物Fe3+为0.15mol |
科目:gzhx 来源: 题型:
将16gFeS与FeO的混合物,投入到1L1mol/L的硝酸溶液中充分反应,只产生1/3molNO气体,得到澄清的混合溶液。下列计算结果正确的是
A.混合物中含有0.5molFeS B.混合物中含有0.1mol FeO
C.参加反应的HNO3为1mol D.氧化产物Fe3+为0.15mol
科目:gzhx 来源: 题型:
科目:gzhx 来源:启东市汇龙中学迎二模模拟考试(二)、化学 题型:021
|
将16 g FeS与FeO的混合物,投入到含有1 mol的硝酸溶液中充分反应,只产生 | |
A. |
混合物中含有0.1 mol FeS |
B. |
混合物中含有8 g FeO |
C. |
被还原的HNO3为 |
D. |
参加反应的HNO3为1 mol |
科目:gzhx 来源:黑龙江省大庆实验中学2011届高三上学期期末考试化学试题 题型:021
|
将16 g FeS与FeO的混合物,投入到1 L 1 mol/L的硝酸溶液中充分反应,只产生1/3 mol NO气体,得到澄清的混合溶液.下列计算结果正确的是 | |
A. |
混合物中含有0.5 mol FeS |
B. |
混合物中含有0.1 mol FeO |
C. |
参加反应的HNO3为1 mol |
D. |
氧化产物Fe3+为0.15 mol |
科目:gzhx 来源:新人教版2012届高三上学期单元测试(5)化学试题 人教版 题型:013
|
将16 g FeS与FeO的混合物,投入到含有1 mol的硝酸溶液中充分反应,只产生1/3 mol NO气体,得到澄清的混合溶液.下列计算结果正确的是 | |
| [ ] | |
A. |
混合物中含有0.5 mol FeS |
B. |
混合物中含有0.1 mol FeO |
C. |
参加反应的HNO3为1 mol |
D. |
氧化产物Fe3+为0.15 mol |
科目:gzhx 来源: 题型:单选题
科目:gzhx 来源:2011-2012学年江苏省淮安市清河区清江中学高一(上)期中化学试卷(解析版) 题型:选择题
科目:gzhx 来源: 题型:单选题
科目:gzhx 来源: 题型:
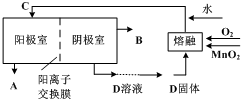
科目:gzhx 来源: 题型:
| A、1OOmL | B、160mL | C、240mL | D、307mL |
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:阅读理解
| ||
| ||
| ||
| ||
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型: