B、电解过程中阳极质量的减少与阴极质量的增加不相等答案解析
科目:gzhx
来源:2013-2014学年广东省等六校高三第三次联考理综化学试卷(解析版)
题型:选择题
下列有关用惰性电极电解AgNO3溶液的说法不正确的是:
A.电解过程中阴极质量不断增大
B.电解过程中阳极附近的pH不断降低
C.电解一段时间后,向溶液中加入适量的Ag2O固体可使溶液恢复到电解前的状况
D.电解过程中,溶液中电子由阴极迁向阳极
查看答案和解析>>
科目:gzhx
来源:
题型:
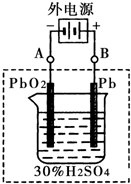
(1)铅蓄电池的电池总反应式为:
Pb+PbO
2+4H
++2SO
42-2PbSO
4+2H
2O回答下列问题.(不考虑氢、氧的氧化还原)
①放电时:负极的电极反应式是
Pb+SO42--2e-=PbSO4
Pb+SO42--2e-=PbSO4
,电解液中H
2SO
4的浓度将变
小
小
,当外电路通过2mol电子时,理论上负极板的质量增加
96
96
g.
②在完全放电耗尽PbO
2和Pb时,将原Pb和PbO
2极板按右图连接,电解一段时间后,则在A电极上生成
Pb
Pb
,B电极上生成
PbO2
PbO2
.
(2)三氧化二镍(Ni
2O
3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl
2溶液pH至7.5,加放适量硫酸钠后进行电解.电解过程中产生的Cl
2在弱碱性条件下生成ClO
-,把二价镍氧化为三价镍.以下说法正确的是
cd
cd
a.可用铁作阳极材料
b.电解过程中阳极附近溶液的pH升高
c.阳极反应方程式为:2Cl
--2e
-=Cl
2↑
d.1mol二价镍全部转化为三价镍时,外电路中通过了1mol电子.
查看答案和解析>>
科目:gzhx
来源:2010-2011学年湖南嘉禾一中高三1月份高考押题化学试卷
题型:选择题
用铂电极电解一定质量某浓度的CuSO4,一段时间后停止电解。若此时加入19.6gCu(OH)2,所得溶液恰好与原溶液完全相同,则下列说法不正确的是
A.原溶液中溶质的质量为32g
B.电解过程中转移电子的物质的量为0.8mol
C.电解过程中阳极产生的气体在标准状况下的体积为4.48L
D.在相同条件下,阴极得到气体的体积大于阳极得到气体的体积
查看答案和解析>>
科目:gzhx
来源:
题型:
用铂电极电解一定质量某浓度的CuSO4,一段时间后停止电解。若此时加入19.6gCu(OH)2,所得溶液恰好与原溶液完全相同,则下列说法不正确的是
A.原溶液中溶质的质量为32g
B.电解过程中转移电子的物质的量为0.8mol
C.电解过程中阳极产生的气体在标准状况下的体积为4.48L
D.在相同条件下,阴极得到气体的体积大于阳极得到气体的体积
查看答案和解析>>
科目:gzhx
来源:2014届山东省威海市高二上学期期末考试化学试卷(解析版)
题型:填空题
(1)铅蓄电池的电池总反应式为:
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O回答下列
问题。(不考虑氢、氧的氧化还原)
2PbSO4+2H2O回答下列
问题。(不考虑氢、氧的氧化还原)
①放电时:负极的电极反应式是 ,
电解液中H2SO4的浓度将变________,当外电路通过2mol电子时,理论上负极板的质量增加 g。
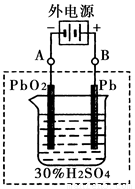
②在完全放电耗尽PbO2和Pb时,将原Pb和PbO2极板 按下图连接,电解一段时间后,则在A电极上生成
__________,B电极上生成________。
(2)三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是
a.可用铁作阳极材料
b.电解过程中阳极附近溶液的pH升高
c.阳极反应方程式为:2Cl--2e-=Cl2↑
d.1 mol二价镍全部转化为三价镍时,外电路中通过了1mol电子。
查看答案和解析>>
科目:gzhx
来源:2012-2013学年山东省威海市高二上学期期末考试化学试卷(带解析)
题型:填空题
(1)铅蓄电池的电池总反应式为:
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O回答下列 问题。(不考虑氢、氧的氧化还原)
2PbSO4+2H2O回答下列 问题。(不考虑氢、氧的氧化还原)
①放电时:负极的电极反应式是 , 电解液中H2SO4的浓度将变________,当外电路通过2mol电子时,理论上负极板的质量增加 g。
②在完全放电耗尽PbO2和Pb时,将原Pb和PbO2极板 按下图连接,电解一段时间后,则在A电极上生成 __________,B电极上生成________。

(2)三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是
a.可用铁作阳极材料
b.电解过程中阳极附近溶液的pH升高
c.阳极反应方程式为:2Cl--2e-=Cl2↑
d.1 mol二价镍全部转化为三价镍时,外电路中通过了1mol电子。
查看答案和解析>>
科目:gzhx
来源:2012-2013学年山东省威海市高二(上)期末化学试卷(解析版)
题型:解答题
(1)铅蓄电池的电池总反应式为:
Pb+PbO
2+4H
++2SO
42-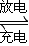
2PbSO
4+2H
2O回答下列问题.(不考虑氢、氧的氧化还原)
①放电时:负极的电极反应式是______,电解液中H
2SO
4的浓度将变______,当外电路通过2mol电子时,理论上负极板的质量增加______g.
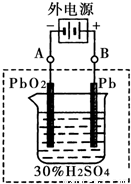
②在完全放电耗尽PbO
2和Pb时,将原Pb和PbO
2极板按右图连接,电解一段时间后,则在A电极上生成______,B电极上生成______.
(2)三氧化二镍(Ni
2O
3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl
2溶液pH至7.5,加放适量硫酸钠后进行电解.电解过程中产生的Cl
2在弱碱性条件下生成ClO
-,把二价镍氧化为三价镍.以下说法正确的是______
a.可用铁作阳极材料
b.电解过程中阳极附近溶液的pH升高
c.阳极反应方程式为:2Cl
--2e
-=Cl
2↑
d.1mol二价镍全部转化为三价镍时,外电路中通过了1mol电子.
查看答案和解析>>
科目:gzhx
来源:
题型:
(1)铅蓄电池的电池总反应式为:
Pb+PbO2+4H++2SO42- 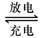 2PbSO4+2H2O回答下列
2PbSO4+2H2O回答下列
问题。(不考虑氢、氧的氧化还原)
①放电时:负极的电极反应式是 ,
电解液中H2SO4的浓度将变________,当外电路通过
2mol电子时,理论上负极板的质量增加 g。
②在完全放电耗尽PbO2和Pb时,将原Pb和PbO2极板
按右图连接,电解一段时间后,则在A电极上生成 __________,B电极上生成________。
(2)三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是
a.可用铁作阳极材料
b.电解过程中阳极附近溶液的pH升高
c.阳极反应方程式为:2Cl--2e-=Cl2↑
d.1 mol二价镍全部转化为三价镍时,外电路中通过了1mol电子。
查看答案和解析>>
科目:gzhx
来源:不详
题型:问答题
(1)铅蓄电池的电池总反应式为:
Pb+PbO
2+4H
++2SO
42-2PbSO
4+2H
2O回答下列问题.(不考虑氢、氧的氧化还原)
①放电时:负极的电极反应式是______,电解液中H
2SO
4的浓度将变______,当外电路通过2mol电子时,理论上负极板的质量增加______g.
②在完全放电耗尽PbO
2和Pb时,将原Pb和PbO
2极板按右图连接,电解一段时间后,则在A电极上生成______,B电极上生成______.
(2)三氧化二镍(Ni
2O
3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl
2溶液pH至7.5,加放适量硫酸钠后进行电解.电解过程中产生的Cl
2在弱碱性条件下生成ClO
-,把二价镍氧化为三价镍.以下说法正确的是______
a.可用铁作阳极材料
b.电解过程中阳极附近溶液的pH升高
c.阳极反应方程式为:2Cl
--2e
-=Cl
2↑
d.1mol二价镍全部转化为三价镍时,外电路中通过了1mol电子.
查看答案和解析>>
科目:gzhx
来源:湖南省嘉禾一中2011届高三1月高考押题卷化学试题
题型:021
|
用铂电极电解一定质量某浓度的CuSO4,一段时间后停止电解.若此时加入19.6 g Cu(OH)2,所得溶液恰好与原溶液完全相同,则下列说法不正确的是
|
A. |
原溶液中溶质的质量为32 g
|
B. |
电解过程中转移电子的物质的量为0.8 mol
|
C. |
电解过程中阳极产生的气体在标准状况下的体积为4.48 L
|
D. |
在相同条件下,阴极得到气体的体积大于阳极得到气体的体积
|
查看答案和解析>>
科目:gzhx
来源:
题型:
用铂电极电解一定质量某浓度的CuSO4,一段时间后停止电解。若此时加入19.6gCu(OH)2,所得溶液恰好与原溶液完全相同,则下列说法不正确的是
A.原溶液中溶质的质量为32g
B.电解过程中转移电子的物质的量为0.8mol
C.电解过程中阳极产生的气体在标准状况下的体积为4.48L
D.在相同条件下,阴极得到气体的体积大于阳极得到气体的体积
查看答案和解析>>
科目:gzhx
来源:
题型:
用铂电极电解一定质量某浓度的CuSO4,一段时间后停止电解。若此时加入19.6gCu(OH)2,所得溶液恰好与原溶液完全相同,则下列说法不正确的是
A.原溶液中溶质的质量为32g
B.电解过程中转移电子的物质的量为0.8mol
C.电解过程中阳极产生的气体在标准状况下的体积为4.48L
D.在相同条件下,阴极得到气体的体积大于阳极得到气体的体积
查看答案和解析>>
科目:gzhx
来源:
题型:
二氧化氯(ClO
2)被称作第四代杀菌消毒剂.
(1)工业上用NaCl还原NaClO
3生产ClO
2的工艺流程如下图所示:
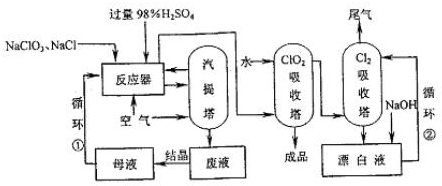
①反应器中发生反应的化学方程式为:
2NaClO
3+2NaCl+2H
2SO
4=2ClO
2↑+Cl
2↑+2Na
2SO
4+2H
2O
生产中将NaClO
3和NaCl按物质的量之比1:1.05的混合水溶液加入反应器,NaCl稍过量的目的是
.
②反应器中生成的ClO
2和Cl
2由通入空气驱出进入ClO
2吸收塔,产生的混合液进入汽提塔,汽提塔排出的废液成分主要是
(填化学式,下同).
③以上生产流程中循环②循环利用的物质是
.
④为提高ClO
2的产量,可用亚氯酸钠(NaClO
2)与反应器中Cl
2反应生成ClO
2,该反应的化学方程式为
.尾气中的Cl
2可用SO
2水溶液吸收,该反应的化学方程式为
.
(2)用阳离子交换膜分隔的电解池电解450g/L NaClO
2溶液,可在阳极室产生ClO
2,在阴极室产生H
2和NaOH.下列有关说法正确的是
(填字母符号).
A.电解时电子流向为:电源负极→导线→阴极,阳极→导线→电源正极
B.在电解过程中,Na
+向阳极移动,ClO
2-向阴极移动
C.在电解过程中阳极周围的pH基本不变
D.电解的离子方程式可表示为:2ClO
2-+2H
2O
2ClO
2↑+H
2↑+2OH
-.
查看答案和解析>>
科目:gzhx
来源:
题型:

在如图装置中,若通电一段时间后铜电极质量增加,则下列说法不正确的是( )
查看答案和解析>>
科目:gzhx
来源:
题型:
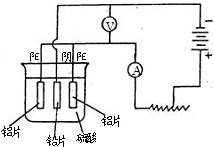
铝及铝合金经过阳极氧化,铝表面能生成几十微米的氧化铝膜.某研究性学习小组模拟工业法对铝片表面进行氧化处理.他们的实验步骤如下:
a.铝片的预处理,取出一定大小的铝片,依次用苯、酒精擦洗铝片的表面
b.用水冲洗经有机物擦洗的铝片,浸入60~70℃的2mol/L的NaOH溶液中,约l min后,取出用水冲洗干净,再用钼酸铵溶液处理以抑制电解生成的氧化铝被硫酸溶解.
c.阳极氧化.以铅为阴极,铝片为阳极,以硫酸溶液为电解液,按照下图连接电解装置,电解40min后取出铝片,用水冲洗,放在水蒸汽中封闭处理20~30min,即可得到更加致密的氧化膜.
试回答下列问题
(1)用苯和酒精擦拭铝片的目的:
,氢氧化钠溶液处理铝片的目的是:
.
(2)下列有关说法正确的是
(填序号).
A.电解时电流从电源正极→导线→铝极,铅极→导线→电源负极
B.在电解过程中,H
+向阳极移动,SO
42-向阴极移动
C.电解过程中阳极周围的pH明显增大
D.电解的总方程式可表示为:2Al+6H
+ 2Al
3++3H
2↑
(3)阴极的电极反应式为:
.
查看答案和解析>>
科目:gzhx
来源:
题型:
工业上生产氯气,常用电解槽中电解饱和食盐水,为了避免电解产物之间发生反应,常用阳离子交换膜将电解槽隔成两部分.下图(左图)为电解槽的示意图.
(1)这种阳离子交换膜,只允许溶液中的
③⑤
③⑤
通过.(填下列微粒的编号)
①H
2②Cl
2③H
+④Cl
-⑤Na
+⑥OH
-(2)写出在电解过程中阳极发生的电极方程式:
2Cl─-2e-=Cl2↑
2Cl─-2e-=Cl2↑
.
(3)已知某电解槽每小时加入10%的氢氧化钠溶液10kg,每小时能收集到标况下的氢气896L,而且两边的水不能自由流通.则理论上计算,电解后流出的氢氧化钠溶液的质量分数为
35.7%
35.7%
.
(4)某化学课外兴趣小组设计了用电解法制取乙醇钠的工业方法,所用的电解槽如图所示,设计要求:①所用的交换膜不能让分子自由通过;②电解过程中消耗的原料是氢氧化钠和乙醇.回答下列问题:

①写出在电解过程中阴极发生的电极方程式
2CH3CH2OH+2e-=2CH3CH2O-+H2↑
2CH3CH2OH+2e-=2CH3CH2O-+H2↑
.
②最后从乙醇钠的乙醇溶液中分离得到纯净乙醇钠固体的方法是:
蒸发结晶
蒸发结晶
.
查看答案和解析>>
科目:gzhx
来源:
题型:

铝及铝合金经过阳极氧化,铝表面能生成几十微米的氧化铝膜.某研究性学习小组模拟工业法对铝片表面进行氧化处理,其装置如图所示.现以铅为阴极,铝片为阳极,以硫酸溶液为电解液,按照右图连接电解装置,电解40min后取出铝片,用水冲洗,在其表面即可得到致密的氧化膜.下列有关说法正确的是( )
|
|
|
|
查看答案和解析>>
科目:gzhx
来源:
题型:
三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解.电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍.以下说法正确的是( )
查看答案和解析>>
科目:gzhx
来源:
题型:
三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解.电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍.以下说法正确的是( )
查看答案和解析>>
科目:gzhx
来源:2010年海南省高二上学期教学质量检测(三)化学试卷
题型:选择题
三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加入适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO—,把二价镍氧化为三价镍。以下说法正确的是
A.可用铁作阳极材料
B.电解过程中阳极附近溶液的pH升高
C.阳极反应方程式是:2Cl—-2e—=====Cl2
D.产生能使1mol二价镍转化为三价镍所需的Cl2,外电路中通过了1mol电子
查看答案和解析>>

 (1)铅蓄电池的电池总反应式为:
(1)铅蓄电池的电池总反应式为: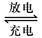 2PbSO4+2H2O回答下列
问题。(不考虑氢、氧的氧化还原)
2PbSO4+2H2O回答下列
问题。(不考虑氢、氧的氧化还原)
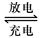 2PbSO4+2H2O回答下列 问题。(不考虑氢、氧的氧化还原)
2PbSO4+2H2O回答下列 问题。(不考虑氢、氧的氧化还原)
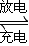 2PbSO4+2H2O回答下列问题.(不考虑氢、氧的氧化还原)
2PbSO4+2H2O回答下列问题.(不考虑氢、氧的氧化还原)
![]() 2PbSO4+2H2O回答下列
2PbSO4+2H2O回答下列 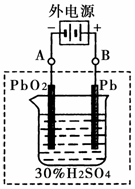


 铝及铝合金经过阳极氧化,铝表面能生成几十微米的氧化铝膜.某研究性学习小组模拟工业法对铝片表面进行氧化处理.他们的实验步骤如下:
铝及铝合金经过阳极氧化,铝表面能生成几十微米的氧化铝膜.某研究性学习小组模拟工业法对铝片表面进行氧化处理.他们的实验步骤如下:
 铝及铝合金经过阳极氧化,铝表面能生成几十微米的氧化铝膜.某研究性学习小组模拟工业法对铝片表面进行氧化处理,其装置如图所示.现以铅为阴极,铝片为阳极,以硫酸溶液为电解液,按照右图连接电解装置,电解40min后取出铝片,用水冲洗,在其表面即可得到致密的氧化膜.下列有关说法正确的是( )
铝及铝合金经过阳极氧化,铝表面能生成几十微米的氧化铝膜.某研究性学习小组模拟工业法对铝片表面进行氧化处理,其装置如图所示.现以铅为阴极,铝片为阳极,以硫酸溶液为电解液,按照右图连接电解装置,电解40min后取出铝片,用水冲洗,在其表面即可得到致密的氧化膜.下列有关说法正确的是( )