
科目:gzhx 来源: 题型:
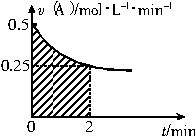
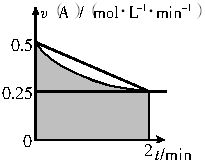
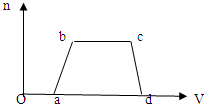
某溶液中发生反应:A=2B+C,速率-时间的关系如图。已知溶液的体积为2L,起始时体系中只有A。则图中阴影部分的面积表示______,应小于_______。
科目:gzhx 来源:09-10学年浠水一中高二下学期期中考试化学卷 题型:选择题
某溶液中发生反应:A=2B+C,A的反应速率v(A)与时间t的图象如图所示。若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是
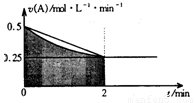
A.图中阴影部分的面积表示0~2min内A的物质的量浓度的减小值
B.反应开始的前2min,A的平均反应速率小于0.375mol·L-1·min-1
C.至2min时,A的物质的量减小值介于0.5mol至1mol之间
D.至2min时,c(B)介于1mol·L-1 至1.5mol·L-1 之间
科目:gzhx 来源: 题型:
某溶液中发生反应:A=2B+C,A的反应速率v(A)与时间t的图象如图所示。若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是
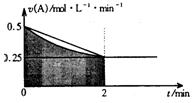
A.图中阴影部分的面积表示0~2min内A的物质的量浓度的减小值
B.反应开始的前2min,A的平均反应速率小于0.375mol·L-1·min-1
C.至2min时,A的物质的量减小值介于0.5mol至1mol之间
D.至2min时,c(B)介于1mol·L-1 至1.5mol·L-1 之间
科目:gzhx 来源: 题型:
某溶液中发生反应:A=2B+C,A的反应速率v(A)与时间t的图象如图所示。若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是
A.图中阴影部分的面积表示0~2min内A的物质的量浓度的减小值
B.反应开始的前2min,A的平均反应速率小于0.375mol·L-1·min-1
C.至2min时,A的物质的量减小值介于0.5mol至1mol之间
D.至2min时,c(B)介于1mol·L-1至1.5mol·L-1 之间
科目:gzhx 来源:09~10学年浠水一中高二下学期期中考试化学卷 题型:单选题
某溶液中发生反应:A=2B+C,A的反应速率v(A)与时间t的图象如图所示。若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是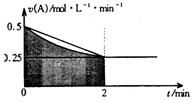
A.图中阴影部分的面积表示0~2min内A的物质的量浓度的减小值
B.反应开始的前2min,A的平均反应速率小于0.375mol·L-1·min-1
C.至2min时,A的物质的量减小值介于0.5mol至1mol之间
D.至2min时,c(B)介于1mol·L-1至1.5mol·L-1之间
科目:gzhx 来源:知识精讲与能力训练 高三化学 题型:022
某溶液中发生反应:A![]() 2B+C,VA-t的关系如图.已知溶液的体积为2L,起始时体系中只有A,请回答下列问题:
2B+C,VA-t的关系如图.已知溶液的体积为2L,起始时体系中只有A,请回答下列问题:
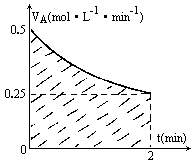
(1)图中阴影部分的面积表示2min内________的减小值,应小于________.
(2)2min时,B的物质的量浓度的取值范围是________.
科目:gzhx 来源:平阳三中2006-2007学年高二年级上学期期中考试 化学试卷 题型:013
|
某溶液中发生反应:A
| |
| [ ] | |
A. |
图中阴影部分的面积表示0—2 min内A的物质的量浓度的减小值 |
B. |
反应开始的前2 min,A的平均反应速率小于0.375 mol·L-1·min-1 |
C. |
至2 min时,A的物质的量减小值介于0.5 mol至1 mol之间 |
D. |
至2 min时,c(B)介于1 mol·L-1至1.5 mol·L-1之间 |
科目:gzhx 来源:物理教研室 题型:038

(1)图中阴影部分的面积表示0~2 min内的________减小值,求它的最小值.
(2)2min时,B物质的量浓度的取值范围是多少?
科目:gzhx 来源:模拟题 题型:推断题
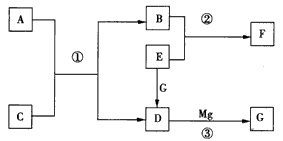
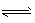 B(s)+D(g) △H=akJ/mol(a>0),该温度下平衡常数K=0.263。若生成1 mol B,则吸收的热量____(选填“大于”、“等于”或“小于”)a kJ;若加入过量的A,则C的转化率__ (选填“升高”、“不变”或“降低”);若容器内压强不再随时间变化,则该反应__ (选填“达到”、“未达到”或“不一定达到”)化学平衡状态;该反应达到化学平衡状态时,若c( C) =0. 100 mol/L,则c(D)=___mol/L。
B(s)+D(g) △H=akJ/mol(a>0),该温度下平衡常数K=0.263。若生成1 mol B,则吸收的热量____(选填“大于”、“等于”或“小于”)a kJ;若加入过量的A,则C的转化率__ (选填“升高”、“不变”或“降低”);若容器内压强不再随时间变化,则该反应__ (选填“达到”、“未达到”或“不一定达到”)化学平衡状态;该反应达到化学平衡状态时,若c( C) =0. 100 mol/L,则c(D)=___mol/L。 科目:gzhx 来源: 题型:
某溶液中发生反应A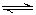 2B+C,A的反应速率v(A)与时间t的关系如下图所示。若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是( )。
2B+C,A的反应速率v(A)与时间t的关系如下图所示。若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是( )。
A.图中阴影部分的面积表示0~2min内A的物质的量浓度的减小值
B.反应开始的前2min,A的平均反应速率小于0.375mol・L-1・min-1
C.至2min时,A的物质的量减小值介于0.5~1mol之间
D.至2min时,B的物质的量浓度c(B)介于1~1.5mol・L-1之间
科目:gzhx 来源: 题型:
①20 mL 0.2 mol ·L-1 A+20 mL 0.2 mol ·L-1 B
②50 mL 0.5 mol ·L-1 A+50 mL 0.5 mol ·L-1 B
③10 mL 1 mol ·L-1 A+10 mL 1 mol ·L-1 B+30 mL H2O
④20 mL 1 mol ·L-1 A+60 mL 0.4 mol ·L-1 B
⑤30 mL 0.6 mol ·L-1 A+30 mL 0.6 mol ·L-1 B
A.②④⑤①③ B.⑤④②③① C.④②⑤①③ D.③⑤④②①
科目:gzhx 来源: 题型:
| 选用试剂 | 实验现象 | |
| 第一种方法 | ||
| 第二种方法 |
| 实验步骤 | 实验现象 |
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:阅读理解
| ||
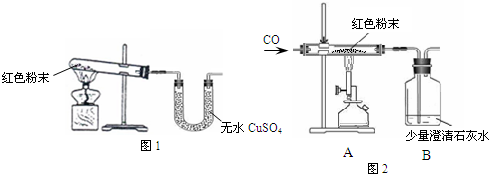
| 反应前 | 反应后 | |
| Ⅰ 组 |
玻璃管和红色粉末的总质量为37.3g | 玻璃管和固体物质的总质量为36.1g |
| Ⅱ 组 |
洗气瓶和所盛溶液 的总质量为180.0g |
洗气瓶和瓶中物质 的总质量为183.1g |
科目:gzhx 来源: 题型:
 2OH-+Cl2↑+H2↑
2OH-+Cl2↑+H2↑ 2OH-+Cl2↑+H2↑
2OH-+Cl2↑+H2↑
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:
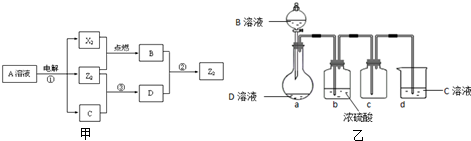
| ||
| ||
科目:gzhx 来源: 题型:阅读理解
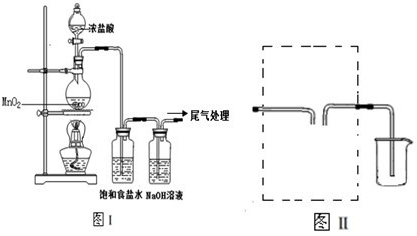
| ||
| ||
科目:gzhx 来源: 题型:

科目:gzhx 来源: 题型:
| 可能大量含有的阳离子 | H+、K+、Mg2+、Al3+、NH4+、Fe2+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32-、AlO2- |
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | a mol | 0 | 0 |