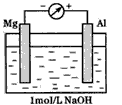
以镁条 铝片为电极 以稀NaOH溶液为电解质溶液构成的原电池答案解析
科目:gzhx
来源:2010年浙江省温州中学高一第二学期期中考试化学试卷
题型:填空题
(10分) 以铁、铜为两电极,稀硫酸为电解质所构成的原电池:
(1)导线中电流流向 ( 选填“铁”或“铜”) ,电极Fe是_____(选填“正”或“负”) 极,其电极反应式为 ;
(2)Cu电极的电极反应式为 ,发生 反应(选填“氧化”或“还原”);
(3)该原电池反应的总反应式(写对应的离子方程式)是: ,通过该原电池装置实现了从化学能向 的转化。
查看答案和解析>>
科目:gzhx
来源:2010年浙江省高一第二学期期中考试化学试卷
题型:填空题
(10分) 以铁、铜为两电极,稀硫酸为电解质所构成的原电池:
(1)导线中电流流向
( 选填“铁”或“铜”) ,电极Fe是_____(选填“正”或“负”) 极,其电极反应式为 ;
(2)Cu电极的电极反应式为 ,发生
反应(选填“氧化”或“还原”);
(3)该原电池反应的总反应式(写对应的离子方程式)是:
,通过该原电池装置实现了从化学能向
的转化。
查看答案和解析>>
科目:gzhx
来源:
题型:
(10分) 以铁、铜为两电极,稀硫酸为电解质所构成的原电池:
(1)导线中电流流向 ( 选填“铁”或“铜”) ,电极Fe是_____(选填“正”或“负”) 极,其电极反应式为 ;
(2)Cu电极的电极反应式为 ,发生 反应(选填“氧化”或“还原”);
(3)该原电池反应的总反应式(写对应的离子方程式)是: ,通过该原电池装置实现了从化学能向 的转化。
查看答案和解析>>
科目:gzhx
来源:
题型:
以铁、铜为两电极,稀硫酸为电解质所构成的原电池:
(1)导线中电流流向 ( 选填“铁”或“铜”) ,电极Fe是_____(选填“正”或“负”) 极,其电极反应式为 ;
(2)Cu电极的电极反应式为 ,发生 反应(选填“氧化”或“还原”);
(3)该原电池反应的总反应式(写对应的离子方程式)是: ,通过该原电池装置实现了从化学能向 的转化。
查看答案和解析>>
科目:gzhx
来源:
题型:
实验是化学的最高法庭。以镁条、铝片为电极,以稀NaOH溶液为电解质溶液构成的原电池,人们普遍认为铝是负极。某研究性学习小组为探究该原电池究竟谁是负极,发生怎样的电极反应,进行了如下实验:
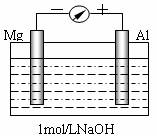
如图,剪取约8cm的镁条及大小相近的铝片,用砂纸去膜,使镁条与铝片分别与量程为500μA的教学演示电表的“-”、“+”端相连接,迅速将两电极插入盛有1mol/LNaOH溶液的烧杯中。开始,电表指针向右偏移约500μA,铝片表面有许多气泡,很快电流逐渐减小至0;随后,指针向左偏移,且电流逐渐增大至约400μA,此时,铝片表面气泡有所减少,但镁条表面只有极少量的气泡产生。根据以上实验现象,回答下列问题:
(1)开始阶段,原电池的正极是____(填“Mg”或“Al”)片;铝片表面产生的气泡是____;负极发生的反应是 。
(2)随后阶段,铝片发生的电极反应式是______________________________;镁条表面只有极少量的气泡产生,其原因是:2H2O+2e-=H2↑+2OH-(极少),试判断此电极发生的主要反应是_________________________;铝片表面气泡有所减少,但未消失,产生这一现象的可能原因是 。
查看答案和解析>>
科目:gzhx
来源:
题型:
实验是化学的最高法庭。以镁条、铝片为电极,以稀NaOH溶液为电解质溶液构成的原电池,人们普遍认为铝是负极。某研究性学习小组为探究该原电池究竟哪种金属作负极,发生怎样的电极反应,进行了如下实验:
如图,剪取约8 cm的镁条及大小相近的铝片,用砂纸去膜,使镁条与铝片分别与量程为500 μA的教学演示电表的“-”“+”端相连接,迅速将两电极插入盛有1 mol·L-1 NaOH溶液的烧杯中。
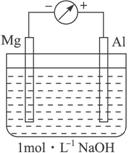
开始,电表指针向右偏移约500 μA,铝片表面有许多气泡,很快电流逐渐减小至0;随后,指针向左偏移,且电流逐渐增大至约400 μA,此时,铝片表面气泡有所减少,但镁条表面只有极少量的气泡产生。
根据以上实验现象,回答下列问题:
(1)开始阶段,原电池的正极是__________(填“Mg”或“Al”)片;铝片表面产生的气泡是__________;负极发生的电极反应是________________________________________。
(2)随后阶段,铝片发生的电极反应式是__________;镁条表面只有极少量的气泡产生,其原因是:2H2O+2e-====H2↑+2OH-(极少),试判断此电极发生的主要反应是__________;铝片表面气泡有所减少,但未消失,产生这一现象的可能原因是___________________________。
查看答案和解析>>
科目:gzhx
来源:2007届江阴市高三化学第一次模拟试题(人教) 人教
题型:058
|
|
实验是化学的最高法庭.以镁条、铝片为电极,以稀NaOH溶液为电解质溶液构成的原电池,人们普遍认为铝是负极.某研究性学习小组为探究该原电池究竟谁是负极,发生怎样的电极反应,进行了如下实验:
如图,剪取约8cm的镁条及大小相近的铝片,用砂纸去膜,使镁条与铝片分别与量程为500μA的教学演示电表的“-”、“+”端相连接,迅速将两电极插入盛有1mol/LNaOH溶液的烧杯中.开始,电表指针向右偏移约500μA,铝片表面有许多气泡,很快电流逐渐减小至0;随后,指针向左偏移,且电流逐渐增大至约400μA,此时,铝片表面气泡有所减少,但镁条表面只有极少量的气泡产生.根据以上实验现象,回答下列问题:
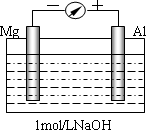
| (1) |
|
开始阶段,原电池的正极是________(填“Mg”或“Al”)片;铝片表面产生的气泡是________;负极发生的反应是________.
|
|
(2) |
|
随后阶段,铝片发生的电极反应式是________;镁条表面只有极少量的气泡产生,其原因之一是:2H2O+2e-=H2↑+2OH-(极少),试判断此电极发生的主要反应是:________;铝片表面气泡有所减少,但未消失,产生这一现象的可能原因是________.
|
|
|
查看答案和解析>>
科目:gzhx
来源:2007届致远中学高三化学一轮复习效果检测
题型:058
|
|
实验是化学的最高法庭.以镁条、铝片为电极,以稀NaOH溶液为电解质溶液构成的原电池,人们普遍认为铝是负极.某研究性学习小组为探究该原电池究竟谁是负极,发生怎样的电极反应,进行了如下实验:
如图,剪取约8cm的镁条及大小相近的铝片,用砂纸去膜,使镁条与铝片分别与量程为500μA的教学演示电表的“-”、“+”端相连接,迅速将两电极插入盛有1mol/LNaOH溶液的烧杯中.开始,电表指针向右偏移约500μA,铝片表面有许多气泡,很快电流逐渐减小至0;随后,指针向左偏移,且电流逐渐增大至约400μA,此时,铝片表面气泡有所减少,但镁条表面只有极少量的气泡产生.根据以上实验现象,回答下列问题:
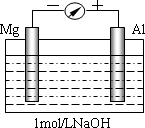
| (1) |
|
开始阶段,原电池的正极是________(填“Mg”或“Al”)片;铝片表面产生的气泡是________;负极发生的反应是________.
|
|
(2) |
|
随后阶段,铝片发生的电极反应式是________;镁条表面只有极少量的气泡产生,其原因之一是:2H2O+2e-=H2↑+2OH-(极少),试判断此电极发生的主要反应是:________;铝片表面气泡有所减少,但未消失,产生这一现象的可能原因是________.
|
|
|
查看答案和解析>>
科目:gzhx
来源:2006-2007学年第一学期万杰朝阳学校高三11月月考、化学
题型:058
|
|
实验是化学的最高法庭.以镁条、铝片为电极,以稀NaOH溶液为电解质溶液构成的原电池,人们普遍认为铝是负极.某研究性学习小组为探究该原电池究竟谁是负极,发生怎样的电极反应,进行了如下实验:
如图,剪取约8cm的镁条及大小相近的铝片,用砂纸去膜,使镁条与铝片分别与量程为500μA的教学演示电表的“-”、“+”端相连接,迅速将两电极插入盛有1mol/LNaOH溶液的烧杯中.开始,电表指针向右偏移约500μA,铝片表面有许多气泡,很快电流逐渐减小至0;随后,指针向左偏移,且电流逐渐增大至约400μA,此时,铝片表面气泡有所减少,但镁条表面只有极少量的气泡产生.根据以上实验现象,回答下列问题:

| (1) |
|
开始阶段,原电池的正极是________(填“Mg”或“Al”)片;铝片表面产生的气泡是________;负极发生的反应是________.
|
|
(2) |
|
随后阶段,铝片发生的电极反应式是________;镁条表面只有极少量的气泡产生,其原因之一是:2H2O+2e-=H2↑+2OH-(极少),试判断此电极发生的主要反应是:________;铝片表面气泡有所减少,但未消失,产生这一现象的可能原因是________.
|
|
|
查看答案和解析>>
科目:gzhx
来源:2007届江苏泗阳致远中学高三化学一轮复习效果检测
题型:058
|
|
实验是化学的最高法庭.以镁条、铝片为电极,以稀NaOH溶液为电解质溶液构成的原电池,人们普遍认为铝是负极.某研究性学习小组为探究该原电池究竟谁是负极,发生怎样的电极反应,进行了如下实验:
如图,剪取约8cm的镁条及大小相近的铝片,用砂纸去膜,使镁条与铝片分别与量程为500μA的教学演示电表的“-”、“+”端相连接,迅速将两电极插入盛有1mol/LNaOH溶液的烧杯中.开始,电表指针向右偏移约500μA,铝片表面有许多气泡,很快电流逐渐减小至0;随后,指针向左偏移,且电流逐渐增大至约400μA,此时,铝片表面气泡有所减少,但镁条表面只有极少量的气泡产生.根据以上实验现象,回答下列问题:

| (1) |
|
开始阶段,原电池的正极是________(填“Mg”或“Al”)片;铝片表面产生的气泡是________;负极发生的反应是________.
|
|
(2) |
|
随后阶段,铝片发生的电极反应式是________;镁条表面只有极少量的气泡产生,其原因之一是:2H2O+2e-=H2↑+2OH-(极少),试判断此电极发生的主要反应是:________;铝片表面气泡有所减少,但未消失,产生这一现象的可能原因是________.
|
|
|
查看答案和解析>>
科目:gzhx
来源:同步题
题型:实验题
实验是化学的最高法庭。以镁条、铝片为电极,以稀NaOH溶液为电解质溶液构成的原电池,人们普遍认为铝是负极。某研究性学习小组为探究该原电池究竟谁是负极,发生怎样的电极反应,进行了如下实验:如下图,剪取约8cm的镁条及大小相近的铝片,用砂纸去膜,使镁条与铝片分别与量程为500μA的教学演示电表的“-”、“+”端相连接,迅速将两电极插入盛有1mol/L NaOH溶液的烧杯中。开始,电表指针向右偏移约500μA,铝片表面有许多气泡,很快电流逐渐减小至0;随后,指针向左偏移,且电流逐渐增大至约400μA,此时,铝片表面气泡有所减少,但镁条表面只有极少量的气泡产生。根据以上实验现象,回答下列问题:
(1)开始阶段,原电池的正极是____(填“Mg”或“Al”)片;铝片表面产生的气泡是____;负极发生的反应是____。
(2)随后阶段,铝片发生的电极反应式____; 镁条表面只有极少量的气泡产生,其原因是:
2H2O+2e-==H2↑+2OH-(极少),试判断此电极发生的主要反应是____;铝片表面气泡有所减少,但未消失,产生这一现象的可能原因是________。
(3)铝表面的氧化膜用砂纸不易除去,而此实验中无需刻意除去,原因是 ____(用化学方程式表示)。 (4)若此实验中的电解质溶液改为稀硫酸,则电池的负极为____(填“Mg”或“Al”)片,其电极反应式为___ 。
查看答案和解析>>
科目:gzhx
来源:江苏省平潮高级中学2006-2007学年度第一学期期中考试、高二化学试卷
题型:058
|
|
实验是化学的最高法庭.以镁、铝为电极,稀NaOH溶液为电解质溶液构成的原电池,人们普遍认为铝是负极.某研究性学习小组为此进行了如下探究实验:如图,剪取大小相近的镁条和铝片,用砂纸去膜,使镁与铝分别与量程为500 μA的教学演示电表的“-”、“+”端相连接,迅速将两电极插入盛有1 mol/L NaOH溶液的烧杯中.开始,电表指针向右偏移约500 μA,铝片表面有许多气泡,很快电流逐渐减小至0;随后,指针向左偏移,且电流逐渐增大至约400 μA,此时,铝片表面气泡有所减少,但镁条表面只有极少量的气泡产生.
根据以上实验现象,回答下列问题:

| (1) |
|
开始阶段,原电池的正极是________(填“Mg”或“Al”)片;负极反应式是________.
|
|
(2) |
|
随后阶段,铝片发生的电极反应式是________;
镁条表面只有极少量的气泡产生,其原因之一是:2H2O+2e-=H2↑+2OH-(极少),试判断此电极发生的主要反应是:________;
铝片表面气泡有所减少,但未消失,产生这一现象的原因可能是________.
|
|
(3) |
|
该研究性学习小组用铝片分别与c(H+)均为3 mol/L的稀盐酸和稀硫酸反应:
实验过程:往装有相同铝片的2支试管中分别加入等体积,且c(H+)=3.0 mol/L的盐酸和硫酸,观察反应进行到1、2、5、15、20 min时铝片与酸反应的情况.
实验结果如下表:
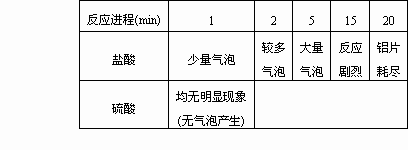
通过上述实验可知,铝片与盐酸和硫酸反应存在较大的差异.这和课本中“铝能与稀盐酸和稀硫酸反应生成氢气”的说法不一致.假如你将开展实验,探究铝片分别与稀盐酸和稀硫酸反应差异的原因,为设计实验,你将对差异的原因作出哪些假设或猜想?你的假设(猜想)是:________;
铝片与3 mol/L的稀盐酸反应时,产生H2的速率经过由慢到快再慢的过程的原因是________.
|
|
|
查看答案和解析>>
科目:gzhx
来源:
题型:
按要求完成下列原电池电极反应式或总反应的化学方程式。
(1)负极(Fe) ;正极(石墨)
电解质溶液(稀硫酸)总反应
(2)负极(Cu) ; 正极(石墨)
电解质溶液(FeCl3溶液)总反应
(3)用Fe和Cu作电极材料,以浓HNO3为电解质溶液构成的原电池,则负极的电极反应式为 ;总反应为
查看答案和解析>>
科目:gzhx
来源:2013届四川省高一3月月考化学试卷
题型:填空题
按要求完成下列原电池电极反应式或总反应的化学方程式。
(1)负极(Fe)
;正极(石墨)
电解质溶液(稀硫酸)总反应
(2)负极(Cu)
; 正极(石墨)
电解质溶液(FeCl3溶液)总反应
(3)用Fe和Cu作电极材料,以浓HNO3为电解质溶液构成的原电池,则负极的电极反应式为
;总反应为
查看答案和解析>>
科目:gzhx
来源:2010—2011学年四川省树德协进中学高一3月月考化学试卷
题型:填空题
按要求完成下列原电池电极反应式或总反应的化学方程式。
(1)负极(Fe) ;正极(石墨)
电解质溶液(稀硫酸)总反应
(2)负极(Cu) ; 正极(石墨)
电解质溶液(FeCl3溶液)总反应
(3)用Fe和Cu作电极材料,以浓HNO3为电解质溶液构成的原电池,则负极的电极反应式为 ;总反应为
查看答案和解析>>
科目:gzhx
来源:
题型:
按要求完成下列原电池电极反应式或总反应的化学方程式。
(1)负极(Fe) ;正极(石墨)
电解质溶液(稀硫酸)总反应
(2)负极(Cu) ; 正极(石墨)
电解质溶液(FeCl3溶液)总反应
(3)用Fe和Cu作电极材料,以浓HNO3为电解质溶液构成的原电池,则负极的电极反应式为 ;总反应为
查看答案和解析>>
科目:gzhx
来源:
题型:
按要求完成下列原电池电极反应式或总反应的化学方程式.
(1)我国发射的“神舟”六号载人飞船是采用先进的甲烷电池为电能的,该电池以KOH溶液为电解质,其总反应的化学方程式为:CH
4+2O
2+2OH
-﹦CO
32-+3H
2O,则:①负极上的电极反应为
CH4-8e-+10OH-=CO32-+7H2O
CH4-8e-+10OH-=CO32-+7H2O
;②当消耗标准状况下的O
216.8升时,有
3
3
mol电子发生转移.
(2)用Fe和Cu作电极材料,以浓HNO
3为电解质溶液构成的原电池,则负极的电极反应式为
Cu-2e_=Cu2+
Cu-2e_=Cu2+
;总反应为
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+H2O
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+H2O
.
查看答案和解析>>
科目:gzhx
来源:
题型:
某种燃料电池是以甲烷(CH4)和空气为原料,以KOH为电解质溶液构成的原电池.电池的总反应类似甲烷在氧气中的燃烧.下列说法正确的是( )
①每消耗1molCH4可以向外电路提供8mole-
②CH4在负极发生氧化反应,电极反应式是:CH4+10OH--8e-=CO32-+7H2O
③燃料电池把化学能直接转化为电能,而不经过热能这一种中间形式,所以它的能量转化效率高,并且减少了对环境的污染
④这种燃料电池要定期更换电解质溶液.
查看答案和解析>>
科目:gzhx
来源:
题型:
按要求完成下列原电池电极反应式或总反应的化学方程式。
(1)我国发射的“神舟”六号载人飞船是采用先进的甲烷电池为电能的,该电池以KOH溶液为电解质,其总反应的化学方程式为:CH4 + 2O2 + 2OH-﹦CO32- +3H2O,则:
①负极上的电极反应为 ;
②当消耗标准状况下的O2 16.8升时,有 mol电子发生转移。
(2)用Fe和Cu作电极材料,以浓HNO3为电解质溶液构成的原电池,则负极的电极反应式为 ;总反应为
查看答案和解析>>
科目:gzhx
来源:2010—2011学年福建省三明二中高一下期期中考试化学试卷
题型:填空题
按要求完成下列原电池电极反应式或总反应的化学方程式。
(1)我国发射的“神舟”六号载人飞船是采用先进的甲烷电池为电能的,该电池以KOH溶液为电解质,其总反应的化学方程式为:CH4 + 2O2 + 2OH-﹦CO32- +3H2O,则:
①负极上的电极反应为 ;
②当消耗标准状况下的O2 16.8升时,有 mol电子发生转移。
(2)用Fe和Cu作电极材料,以浓HNO3为电解质溶液构成的原电池,则负极的电极反应式为 ;总反应为
查看答案和解析>>