
科目:gzhx 来源: 题型:
科目:gzhx 来源:2011-2012学年上海市松江区高三上学期期末(1月)考试化学试卷(解析版) 题型:填空题
(本题共12分)
硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
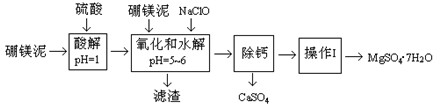
根据题意回答:
1.实验中需用0.8mol/L的硫酸800 mL,若用98%的浓硫酸(ρ= 1.84 g/mL)来配制,量取浓硫酸时,需使用的量筒的规格为
A.10 mL B.20 mL C.50 mL D.100 mL
2.加入的NaClO可与Mn2+反应:Mn2+ + ClO- + H2O → MnO2↓ + 2H+ + Cl-,还有一种离子也会被NaClO氧化,该反应的离子方程式为 。
3.滤渣的主要成份除含有Fe(OH)3、Al(OH)3外,还有 。
4.在“除钙”前,需检验滤液中Fe3+是否被除尽,简述检验方法 。
5.已知MgSO4、CaSO4的溶解度如下表:
|
温度(℃) |
40 |
50 |
60 |
70 |
|
MgSO4 |
30.9 |
33.4 |
35.6 |
36.9 |
|
CaSO4 |
0.210 |
0.207 |
0.201 |
0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤 。“操作I”是将滤液继续蒸发浓缩,冷却结晶, ,便得到了MgSO4·7H2O。
6.实验中提供的硼镁泥共100 g,得到的MgSO4·7H2O为172.2 g,则MgSO4·7H2O的产率为 。
科目:gzhx 来源:2014届四川省高一上学期期中考试化学试卷 题型:填空题
实验室用98%的浓H2SO4(ρ=1.84 g·cm-3)配制1.5 mol·L-1稀H2SO4溶液100 mL。
(1)计算所需浓H2SO4体积为_________。
(2)量取所需浓H2SO4,应选用________________________。
(3)稀释浓H2SO4的方法(简要操作)_____________________________________________
(4)容量瓶使用前,检验其是否漏水的方法是_______________________________________
以下操作会引起最后所配溶液的浓度发生什么变化,请填写(偏高、偏低、无影响)
(5)稀释后的浓H2SO4若立即转移至容量瓶中,所配溶液的浓度将_________
(6)容量瓶用蒸馏洗涤后残留有少量的水________________
(7)所用过的烧杯、玻璃棒未洗涤________________
(8)定容时俯视刻度线________________
科目:gzhx 来源:2012届上海市松江区高三上学期期末(1月)考试化学试卷(带解析) 题型:填空题
(本题共12分)
硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下: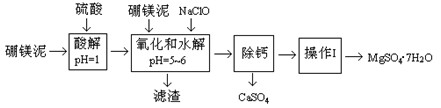
根据题意回答:
1.实验中需用0.8mol/L的硫酸800 mL,若用98%的浓硫酸(ρ=" 1.84" g/mL)来配制,量取浓硫酸时,需使用的量筒的规格为
| A.10 mL | B.20 mL | C.50 mL | D.100 mL |
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
科目:gzhx 来源:2011-2012学年四川省汉源县第一中学高一上学期期中考试化学试卷 题型:填空题
实验室用98%的浓H2SO4(ρ="1.84" g·cm-3)配制1.5 mol·L-1稀H2SO4 溶液100 mL。
溶液100 mL。
(1)计算所需浓H2SO4体积为_________。
(2)量取所需浓H2SO4,应选用________________________。
(3)稀释浓H2SO4的方法(简要操作)_____________________________________________
(4)容量瓶使用前,检验其是否漏水的方法是_________________________________ ______
______
以下操作会引起最后所配溶液的浓度发生什么变化,请填写(偏高、偏低、无影响)
(5)稀释后的浓H2SO4若立即转移至容量瓶中,所配溶液的浓度将_________
( 6)容量瓶用蒸馏洗涤后残留有少量的水________________
6)容量瓶用蒸馏洗涤后残留有少量的水________________
(7)所用过的烧杯、玻璃棒未洗涤________________
(8)定容时俯视刻度线________________
科目:gzhx 来源: 题型:
实验室用98%的浓H2SO4(ρ=1.84 g·cm-3)配制1.5 mol·L-1稀H2SO4溶液100 mL。
(1)计算所需浓H2SO4体积为_________。
(2)量取所需浓H2SO4,应选用________________________。
(3)稀释浓H2SO4的方法(简要操作)_____________________________________________
(4)容量瓶使用前,检验其是否漏水的方法是_______________________________________
以下操作会引起最后所配溶液的浓度发生什么变化,请填写(偏高、偏低、无影响)
(5)稀释后的浓H2SO4若立即转移至容量瓶中,所配溶液的浓度将_________
(6)容量瓶用蒸馏洗涤后残留有少量的水________________
(7)所用过的烧杯、玻璃棒未洗涤________________
(8)定容时俯视刻度线________________
科目:gzhx 来源:2012-2013学年甘肃省高三第二次检测考试化学试卷(解析版) 题型:实验题
(12分)(1)下列每组中都有一种物质与其他物质在分类上不同,试分析每组中物质的组成规律,将这种不同于其他物质的物质找出来.
①NaCl、KCl、NaClO、BaCl2 ②浊液、溶液、胶体、水
(2)用98%的浓H2SO4(ρ=1.84 g/cm3)配制500 ml 0.5 mol/L的稀H2SO4,所需浓H2SO4的体积为________ml(小数点后保留一位有效数字),如果实验室有10 ml、20 ml、50 ml量筒,应选用 ml量筒,实验中还需要用到的仪器有 ,若实验中出现下列现象对所配溶液浓度有什么影响?(填偏高、偏低、无影响)
①浓硫酸溶解后未冷却至室温即转移至容量瓶进行定容________②定容时仰视刻度线
③量取好浓硫酸倒入烧杯溶解后,用水洗涤量筒2-3次,将洗涤液倒入烧杯
(3)7.8g的镁铝合金与足量的稀盐酸反应,生成氢气的体积为8.96L(标准状况),则此反应中转移电子的个数为________________,由镁和铝分别产生的氢气的体积之比为________________
(4)取100ml的Na2CO3和Na2SO4的混合溶液与过量盐酸反应,生成0.896L(标况)CO2;若向原混合溶液中加入足量的Ba(OH)2溶液,得到沉淀的质量为10.21g,试计算混合溶液中Na2CO3的物质的量浓度是___________ mol/L, Na2SO4的物质的量浓度是___________ mol/L。
科目:gzhx 来源:2013届甘肃省甘谷一中高三第二次检测考试化学试卷(带解析) 题型:实验题
(12分)(1)下列每组中都有一种物质与其他物质在分类上不同,试分析每组中物质的组成规律,将这种不同于其他物质的物质找出来.
①NaCl、KCl、NaClO、BaCl2 ②浊液、溶液、胶体、水
(2)用98%的浓H2SO4(ρ=1.84 g/cm3)配制500 ml 0.5 mol/L的稀H2SO4,所需浓H2SO4的体积为________ml(小数点后保留一位有效数字),如果实验室有10 ml、20 ml、50 ml量筒,应选用 ml量筒,实验中还需要用到的仪器有 ,若实验中出现下列现象对所配溶液浓度有什么影响?(填偏高、偏低、无影响)
①浓硫酸溶解后未冷却至室温即转移至容量瓶进行定容________②定容时仰视刻度线
③量取好浓硫酸倒入烧杯溶解后,用水洗涤量筒2-3次,将洗涤液倒入烧杯
(3)7.8g的镁铝合金与足量的稀盐酸反应,生成氢气的体积为8.96L(标准状况),则此反应中转移电子的个数为________________,由镁和铝分别产生的氢气的体积之比为________________
(4)取100ml的Na2CO3和Na2SO4的混合溶液与过量盐酸反应,生成0.896L(标况)CO2;若向原混合溶液中加入足量的Ba(OH)2溶液,得到沉淀的质量为10.21g,试计算混合溶液中Na2CO3的物质的量浓度是___________mol/L, Na2SO4的物质的量浓度是___________mol/L。
科目:gzhx 来源:2007新课标第一学期期中考试高一年级化学试卷(B) 题型:058
| |||||||||||||||||||
科目:gzhx 来源: 题型:
用98%的浓H2SO4(ρ=1.84 g/cm3)配制500 ml 0.5 mol/L的稀H2SO4,请按要求填空:
(1)所需浓H2SO4的体积为________
(2)如果实验室有10 mL、20 mL、50 mL量筒,应选用________mL量筒,实验中还需要用到的仪器有________
(3)若实验中出现下列现象对所配溶液浓度有什么影响?(填偏高、偏低、无影响)
①浓硫酸溶解后未冷至室温即进行定容________
②定容时俯视刻度线________
③量取好浓硫酸倒入烧杯后,用水洗涤量筒2-3次,将洗液倒入烧杯
科目:gzhx 来源: 题型:
(1)化学兴趣小组所制得的气体X中混有的主要杂质气体可能是_________________(填分子式)。产生这种结果的主要原因是(用离子方程式表示)_________________。
(2)为了检验主要杂质气体的成分,化学兴趣小组的同学设计了如下实验,对气体X取样进行认真探究。
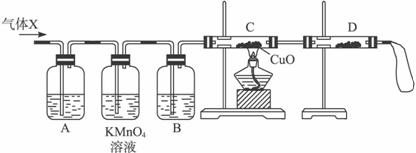
①组装好仪器后,盛放药品前,必要的一个操作是__________________________________。
②A中加入的试剂可能是____________,作用是__________________________________。
B中加入的试剂可能是____________,作用是____________________________________。
③证实气体X中混有较多杂质气体,应观察到C中的实验现象是____________________,D中最好选择的试剂是_________________。
(3)假定气体在吸收过程中吸收完全,对上述装置略加改进,可以粗略测定气体X中SO2的体积分数。改进时可选用的下列仪器为_________________(填代号)。
a.导管 b.水槽 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
科目:gzhx 来源:2010年湖南师大附中高一上学期期中考试化学试卷 题型:填空题
)下面是用98%的浓H2SO4(ρ="1.84" g/cm3)配制成0.5 mol/L的稀H2SO4 500 mL的操作,请按要求填空:
(1)浓硫酸的物质的量浓度为 。
(2)所需浓H2SO4的体积为 。
(3)将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100 mL水的 里,并不断搅拌。
(4)冷却后,将上述溶液转移到 中,用蒸馏水洗涤烧杯2~3次,并将洗涤液注入容量瓶中。
(5)加水至距刻度 处,改用 加水,使溶液的凹液面正好跟刻度相平,摇匀。
科目:gzhx 来源:2010年重庆一中高一12月月考化学试卷 题型:填空题
某次实验需用480 mL、0.5 mol/L 的稀H2SO4溶液,某同学用98%的浓H2SO4 (ρ="1.84" g/cm3)进行配制,请回答下列问题:
(1)98%的浓H2SO4(ρ="1.84" g/cm3)的物质的量浓度为
(2)将下列步骤中的空格内将所用仪器补充填写完整
①用20 mL量筒量取所需的浓硫酸
②将烧杯中的溶液转移到 mL的容量瓶中
③将浓硫酸缓缓注入盛有适量蒸馏水的烧杯中,边加边搅拌
④将溶液冷却,恢复室温
⑤向容量瓶中加入蒸馏水,在距离刻度1~2 cm时,改用 加蒸馏水至刻度线
⑥盖好瓶塞,反复上下颠倒,摇匀
⑦洗涤烧杯2~3次,洗涤液也注入容量瓶中。轻轻摇动容量瓶,使溶液混合均匀。
(3)实验中上述步骤的正确顺序为 (填序号)。
(4)在横线上填写下列各种情况对所配制溶液浓度的影响(选填“偏高”、“偏低”或“无影响”)。
①所用的浓硫酸长时间放置在密封不好的容器中
②量取浓硫酸所用量筒有蒸馏水
③定容时,俯视液面
科目:gzhx 来源: 题型:
某次实验需用480 mL、0.5 mol/L 的稀H2SO4溶液,某同学用98%的浓H2SO4 (ρ=1.84 g/cm3)进行配制,请回答下列问题:
(1)98%的浓H2SO4(ρ=1.84 g/cm3)的物质的量浓度为
(2)将下列步骤中的空格内将所用仪器补充填写完整
①用20 mL量筒量取所需的浓硫酸
②将烧杯中的溶液转移到 mL的容量瓶中
③将浓硫酸缓缓注入盛有适量蒸馏水的烧杯中,边加边搅拌
④将溶液冷却,恢复室温
⑤向容量瓶中加入蒸馏水,在距离刻度1~2 cm时,改用 加蒸馏水至刻度线
⑥盖好瓶塞,反复上下颠倒,摇匀
⑦洗涤烧杯2~3次,洗涤液也注入容量瓶中。轻轻摇动容量瓶,使溶液混合均匀。
(3)实验中上述步骤的正确顺序为 (填序号)。
(4)在横线上填写下列各种情况对所配制溶液浓度的影响(选填“偏高”、“偏低”或“无影响”)。
①所用的浓硫酸长时间放置在密封不好的容器中
②量取浓硫酸所用量筒有蒸馏水
③定容时,俯视液面
科目:gzhx 来源:2011-2012学年江西省高三第一次月考化学试卷(解析版) 题型:选择题
用98%的浓H2SO4(ρ=1.84 g·cm-3)配制1 mol·L-1的稀硫酸100 mL,按配制溶液时仪器的选用顺序排列,选择正确的是
①玻璃棒 ②胶头滴管 ③100 mL容量瓶 ④托盘天平 ⑤50 mL烧杯 ⑥10 mL量筒 ⑦100 mL量筒 ⑧移液管 ⑨滴定管
A.⑥③⑧⑤①② B.③①⑨② C.④⑤③②①⑨ D.⑥⑤①③②
科目:gzhx 来源:2010年重庆一中高一12月月考化学试卷 题型:填空题
某次实验需用480 mL、0.5 mol/L 的稀H2SO4溶液,某同学用98%的浓H2SO4 (ρ=1.84 g/cm3)进行配制,请回答下列问题:
(1)98%的浓H2SO4(ρ=1.84 g/cm3)的物质的量浓度为
(2)将下列步骤中的空格内将所用仪器补充填写完整
①用20 mL量筒量取所需的浓硫酸
②将烧杯中的溶液转移到 mL的容量瓶中
③将浓硫酸缓缓注入盛有适量蒸馏水的烧杯中,边加边搅拌
④将溶液冷却,恢复室温
⑤向容量瓶中加入蒸馏水,在距离刻度1~2 cm时,改用 加蒸馏水至刻度线
⑥盖好瓶塞,反复上下颠倒,摇匀
⑦洗涤烧杯2~3次,洗涤液也注入容量瓶中。轻轻摇动容量瓶,使溶液混合均匀。
(3)实验中上述步骤的正确顺序为 (填序号)。
(4)在横线上填写下列各种情况对所配制溶液浓度的影响(选填“偏高”、“偏低”或“无影响”)。
①所用的浓硫酸长时间放置在密封不好的容器中
②量取浓硫酸所用量筒有蒸馏水
③定容时,俯视液面
科目:gzhx 来源: 题型:
)下面是用98%的浓H2SO4(ρ=1.84 g/cm3)配制成0.5 mol/L的稀H2SO4 500 mL的操作,请按要求填空:
(1)浓硫酸的物质的量浓度为 。
(2)所需浓H2SO4的体积为 。
(3)将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100 mL水的 里,并不断搅拌。
(4)冷却后,将上述溶液转移到 中,用蒸馏水洗涤烧杯2~3次,并将洗涤液注入容量瓶中。
(5)加水至距刻度 处,改用 加水,使溶液的凹液面正好跟刻度相平,摇匀。
科目:gzhx 来源: 题型:
)下面是用98%的浓H2SO4(ρ=1.84 g/cm3)配制成0.5 mol/L的稀H2SO4 500mL的操作,请按要求填空:
(1)浓硫酸的物质的量浓度为 。
(2)所需浓H2SO4的体积为 。
(3)将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100 mL水的 里,并不断搅拌。
(4)冷却后,将上述溶液转移到 中,用蒸馏水洗涤烧杯2~3次,并将洗涤液注入容量瓶中。
(5)加水至距刻度 处,改用 加水,使溶液的凹液面正好跟刻度相平,摇匀。
科目:gzhx 来源: 题型:
某次实验需用480mL、0.5 mol/L 的稀H2SO4溶液,某同学用98%的浓H2SO4(ρ=1.84 g/cm3)进行配制,请回答下列问题:
(1)98%的浓H2SO4(ρ=1.84 g/cm3)的物质的量浓度为
(2)将下列步骤中的空格内将所用仪器补充填写完整
①用20 mL量筒量取所需的浓硫酸
②将烧杯中的溶液转移到 mL的容量瓶中
③将浓硫酸缓缓注入盛有适量蒸馏水的烧杯中,边加边搅拌
④将溶液冷却,恢复室温
⑤向容量瓶中加入蒸馏水,在距离刻度1~2 cm时,改用 加蒸馏水至刻度线
⑥盖好瓶塞,反复上下颠倒,摇匀
⑦洗涤烧杯2~3次,洗涤液也注入容量瓶中。轻轻摇动容量瓶,使溶液混合均匀。
(3)实验中上述步骤的正确顺序为 (填序号)。
(4)在横线上填写下列各种情况对所配制溶液浓度的影响(选填“偏高”、“偏低”或“无影响”)。
①所用的浓硫酸长时间放置在密封不好的容器中
②量取浓硫酸所用量筒有蒸馏水
③定容时,俯视液面
科目:gzhx 来源:2010年湖南师大附中高一上学期期中考试化学试卷 题型:填空题
)下面是用98%的浓H2SO4(ρ=1.84 g/cm3)配制成0.5 mol/L的稀H2SO4 500 mL的操作,请按要求填空:
(1)浓硫酸的物质的量浓度为 。
(2)所需浓H2SO4的体积为 。
(3)将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100 mL水的 里,并不断搅拌。
(4)冷却后,将上述溶液转移到 中,用蒸馏水洗涤烧杯2~3次,并将洗涤液注入容量瓶中。
(5)加水至距刻度 处,改用 加水,使溶液的凹液面正好跟刻度相平,摇匀。