
科目:gzhx 来源: 题型:
21、(4分)某同学设计用AlCl3溶液和Na2S溶液反应制取硫化铝(Al2S3)固体,你认为他能达到目的吗? 原因是(用离子方程式表示): 。配制Na2S溶液时,为了防止水解,常向溶液中加入少量 ,用离子方程式表示Na2S的水解 。
科目:gzhx 来源:2009—2010学年聊城三中高二第二学期第四次阶段性测试化学试题 题型:填空题
21、(4分)某同学设计用AlCl3溶液和Na2S溶液反应制取硫化铝(Al2S3)固体,你认为他能达到目的吗? 原因是(用离子方程式表示): 。配制Na2S溶液时,为了防止水解,常向溶液中加入少量 ,用离子方程式表示Na2S的水解 。
科目:gzhx 来源:2009-2010学年聊城三中高二第二学期第四次阶段性测试化学试题 题型:填空题
21、(4分)某同学设计用AlCl3溶液和Na2S溶液反应制取硫化铝(Al2S3)固体,你认为他能达到目的吗? 原因是(用离子方程式表示): 。配制Na2S溶液时,为了防止水解,常向溶液中加入少量 ,用离子方程式表示Na2S的水解 。
科目:gzhx 来源: 题型:
21、某同学设计用AlCl3溶液和Na2S溶液反应制取硫化铝(Al2S3)固体,你认为他能达到目的吗? 原因是(用离子方程式表示): 。配制Na2S溶液时,为了防止水解,常向溶液中加入少量 ,用离子方程式表示Na2S的水解 。
科目:gzhx 来源:山东省聊城三中2009-2010学年高二下学期第四次阶段性测试化学试题 题型:022
某同学设计用AlCl3溶液和Na2S溶液反应制取硫化铝(Al2S3)固体,你认为他能达到目的吗?________原因是(用离子方程式表示):________.配制Na2S溶液时,为了防止水解,常向溶液中加入少量________,用离子方程式表示Na2S的水解________.
科目:gzhx 来源:山东省济南外国语学校2009-2010学年高二下学期3月质检化学试题 题型:022
某同学设计用AlCl3溶液和Na2S溶液反应制取硫化铝(Al2S3)固体,实验失败,原因是(用方程式表示):________.
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:
(1)盛纯碱溶液的试剂瓶用玻璃塞,时间长了不易打开___________________________。
(2)盛NH4F试剂要用塑料瓶而不用玻璃瓶___________________________。
(3)铵态氮肥不能与草木灰混用___________________________。
(4)实验室配制的CuSO4溶液,常常出现浑浊的原因是___________________________(写离子方程式),可采取在配制时加入少量_________防止浑浊。
(5)某同学想把AlCl3(aq)和Na2S(aq)混合制取Al2S3,但最后得到一种白色絮状沉淀,而且混合液中有臭鸡蛋气味的气体放出。试解释造成此结果的原因,写出反应的离子方程式__________________。
科目:gzhx 来源:同步题 题型:填空题
科目:gzhx 来源: 题型:阅读理解
 二氧化硫和氯气是中学化学中的常见气体,探究二者的制法和性质是十分重要的课题.
二氧化硫和氯气是中学化学中的常见气体,探究二者的制法和性质是十分重要的课题.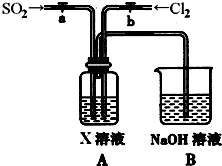
科目:gzhx 来源: 题型:

(1)甲瓶中应装入的试剂是__________溶液,乙瓶中应装入的试剂是__________溶液,分液漏斗中应装入的是__________溶液。
(2)当CO与CO2的混合气体通过该装置时,先分离得到的是__________,活塞操作是__________,然后得到的是__________,活塞操作是__________。
科目:gzhx 来源:2014届河南省顶级名校高三定位测试化学试卷(解析版) 题型:实验题
二氧化硫和氯气是中学化学中的常见气体,探究二者的制法和性质是十分重要的课题。
(1)实验室可由多种途径制取SO2。
途径I:Na2SO3固体与较浓的硫酸(约70%)反应制取;
途径II:铜与浓硫酸加热制取。
如果要在实验室制取SO2,选用上述两种方法中的 (填“途径I”或“途径II”)更合理,你的理由是 (答出一点就可)。
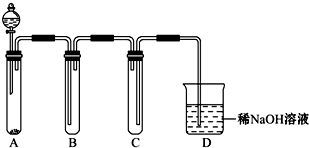
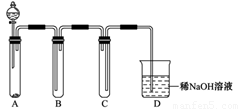
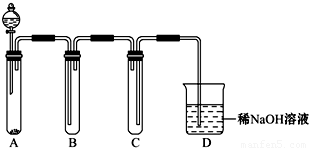
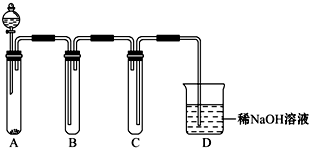
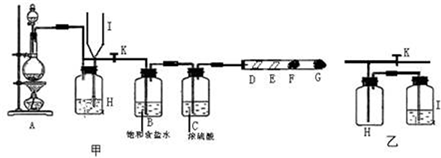
(2)如图是用KMnO4与浓盐酸反应制取适量氯气的简易装置。
已知:2 KMnO4+16HCl(浓)= 2KCl+2MnCl2+5Cl2↑+8H2O。装置B、C、D的作用分别是:
B: ;
C: ;
D: 。
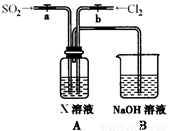
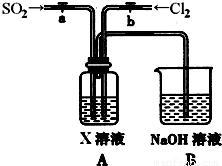
(3)某同学设计用如下装置探究二氧化硫、氯气的化学性质。
通过控制弹簧夹a、b,向装置A中分别通入不同气体,请完成如下问题:
①若关闭b,打开a,若X为品红溶液,则A中的现象为: ,说明二氧化硫具有 性。
②若关闭a,打开b,若X为紫色石蕊试液,则A中的现象为: ,原因是 。
③若同时打开a、b,且通入的气体体积比为1:1,若X为紫色石蕊试液,则A中的现象为 ,与②现象不同的原因是 (书写相应的化学方程式)。
科目:gzhx 来源: 题型:
(1)加入少量NaOH(s),FeCl3的水解程度 。(填“增强”“减弱”或“不变”)
(2)将溶液加热蒸干,并灼烧,最后得到的固体是 。(写化学式)
(3)FeCl3溶液中通入HCl(g),溶液的pH 。(填“增强”“减小”或“不变”)
(4)向FeCl3溶液中滴加石蕊试液,现象是 。
(5)向FeCl3溶液中加入过量Mg片,现象是 。
Ⅱ.某同学想把AlCl3溶液和Na2S溶液混合制取Al2S3,但最后得到一种白色絮状沉淀,并且混合液中有臭鸡蛋气味的气体放出。试解释造成此结果的原因,写出反应的离子方程式,并指出制取硫化铝的正确方法。
科目:gzhx 来源: 题型:
某同学想把AlCl3溶液和Na2S溶液混合制取Al2S3,但最后得到一种白色絮状沉淀,并且混合液中有臭鸡蛋气味的气体放出。试解释造成此结果的原因,写出反应的离子方程式,并指出制取硫化铝的正确方法。
科目:gzhx 来源:2013年山东省高考化学模拟试卷(一)(解析版) 题型:解答题
科目:gzhx 来源: 题型:解答题
 二氧化硫和氯气是中学化学中的常见气体,探究二者的制法和性质是十分重要的课题.
二氧化硫和氯气是中学化学中的常见气体,探究二者的制法和性质是十分重要的课题.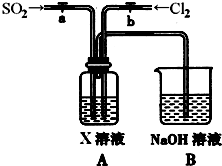
科目:gzhx 来源: 题型:
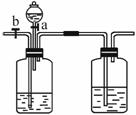
(1)左瓶中应装的是_______溶液,右瓶中应装的是_______溶液,分液漏斗中应装的是_______溶液。
(2)当CO与CO2的混合气体通过该装置时,先分离得到的是_______,活塞操作是_______,然后得到的是_______,活塞操作是_______。
科目:gzhx 来源: 题型:

| ||
| ||
科目:gzhx 来源: 题型:
| ||
| ||
科目:gzhx 来源: 题型:
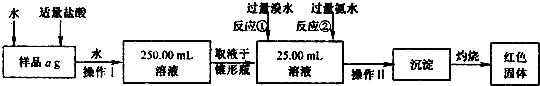
| 700(W2-W1) |
| a |
| 700(W2-W1) |
| a |
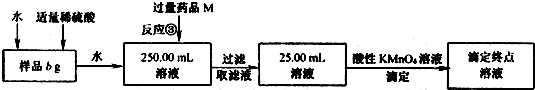
| 280cd |
| b |
| 280cd |
| b |