
科目:gzhx 来源: 题型:
| ||
| ||
科目:gzhx 来源: 题型:解答题
科目:gzhx 来源:2011年北京市朝阳区高考化学二模试卷(解析版) 题型:解答题
科目:gzhx 来源:模拟题 题型:填空题
科目:gzhx 来源: 题型:
(1)写出下列元素的元素符号:B________,D________;写出E的两种常见同素异形体的名称________;C、E的氢化物的沸点高低关系是________(用分子式和“>”表示)。
(2)X是C的最高价氧化物的水化物,它是重要的化学试剂,其浓溶液需避光保存,这是因为(用化学方程式表示)____________________________________。
(3)Y是C的最高价氧化物的水化物和其氢化物反应生成的化合物,常温时,pH=a的X、Y两种溶液中由水电离出来的H+浓度之比为__________________。
(4)X与A、B组成的某化合物在一定条件下反应制得一种常见的烈性炸药,其反应的化学方程式为____________________________________。
(5)由上述元素组成的某化合物其化学式为B
科目:gzhx 来源: 题型:
现有aA、bB、cC、dD、eE五种短周期元素,它们都是生命中不可缺少的重要元素。已知它们的原子序数有如下关系:a+b=c,a+c=d,c+d=e,B、D、E都有多种同素异形体,B的化合物的种类与A的化合物的种类何者最多尚有争议。据此,回答下列有关问题:
(1)写出下列元素的元素符号:B ,D ;写出E的常见两种同素异形体的名称 ;C、E的氢化物的沸点高低关系是 (用分子式和“>”表示)。
(2)X是C的最高价氧化物的水化物,它是重要的化学试剂,其浓溶液需避光保存,这是因为(用化学方程式表示) 。
(3)Y是C的最高价氧化物的水化物和其氢化物反应生成的化合物,常温时,PH= a的X、Y两种溶液中由水电离出来的H+浓度之比为 。
(4)X与A、B组成的某化合物在一定条件下反应制得一种常见的烈性炸药,其反应的化学方程式为 。
(5)由上述元素组成的某化合物其化学式为B8C8D16 ,其分子中B元素原子之间以非极性键结合,非极性键之间的夹角都为90°;同种元素的原子在结构中毫无区别。则此化合物的结构简式为 。
科目:gzhx 来源:2006年五月理科综合模拟化学部分、(第一套) 题型:022
| |||||||||||||||||||
科目:gzhx 来源:安徽省江南十校2011届高三二模冲刺卷理综化学试题 题型:022
现有aA、bB、cC、dD、eE前四周期五种元素,原子序数依次增大.其中B、C、D同周期,A、C、D三种元素的单质在常温下均为气态,B和D都有两种或两种以上同素异形体,a+b+c+d+e=46.回答下列有关问题:
(1)A和B组成的相对分子质量最小的物质化学式是________;CA3分子的空间构型为________;CA3的稳定性比A2D________(填“强”、“弱”).固态BD2的晶体类型为________.
(2)E的基态原子核外电子排布式为________.
B、C、D三种元素的电负性由大到小的顺序为:________(写元素符号).
(3)一种由C、D组成的化合物与BD2互为等电子体,其化学式为________.
(4)X是C的最高价氧化物的水化物,它是重要的化学试剂,其浓溶液保存时有特殊要求,这是因为(用化学方程式表示)________.
(5)已知:B(s)+D2(g)![]() BD2(g);ΔH=-a kJ/mol
BD2(g);ΔH=-a kJ/mol
2BD(g)+D2(g)![]() 2BD2(g);ΔH=-b kJ/mol
2BD2(g);ΔH=-b kJ/mol
写出B和D2反应生成BD的热化学方程式:________.
科目:gzhx 来源:模拟题 题型:实验题
 2CaSO4+2Cl2↑+2H2O。某学习小组利用此反应原理设计如图所示装置制取氯气并探究其性质。
2CaSO4+2Cl2↑+2H2O。某学习小组利用此反应原理设计如图所示装置制取氯气并探究其性质。 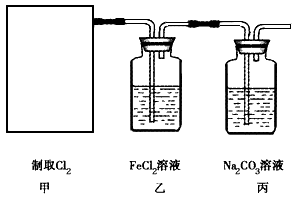
科目:gzhx 来源: 题型:
(1)写出E的两种同素异形体的名称____________;CA3与EA3两者沸点较高的是(用具体物质的化学式表示)_______________。
(2)X是C的最高价氧化物的水化物,它是重要的化学试剂,其浓溶液保存时有特殊要求,这是因为(用化学方程式表示)_____________________________。
(3)等质量的铜片与等体积均过量的X的浓、稀溶液反应,所得到的溶液前者呈绿色,后者呈蓝色。一同学提出溶液呈“绿色”是Cu2+与C元素的某氧化物混合的结果。此处某氧化物指____________,请你设计一个实验证明该同学的结论(简述实验方案和实验现象)_______________。
科目:gzhx 来源: 题型:阅读理解

科目:gzhx 来源:浙江省诸暨中学2011-2012学年高二上学期期中考试化学试题(实验班) 题型:058
硫酸亚铁铵又称莫尔盐,浅绿色晶体,在空气中比一般的亚铁盐稳定,溶于水但不溶于乙醇,化学式为[(NH4)2SO4·FeSO4·6H2O],相对分子质量为392,是常用的分析试剂.在实验室,将FeSO4和(NH4)2SO4两种溶液按一定比例混合,蒸发浓缩、冷却结晶,很容易得到硫酸亚铁铵晶体.某研究性学习小组已制备得到莫尔盐,准备分析研究他们得到的产品.请你帮助完成部分项目:
(1)预测现象:向盛有莫尔盐溶液的大试管中滴加浓NaOH溶液,并不断振荡.
________.
(2)为了确定产品中亚铁含量,研究小组经查阅资料后,打算用KMnO4(酸化)溶液滴定莫尔盐溶液中的Fe2+.离子方程式为:5Fe2++MnO4-+8H+=5Fe2++Mn2++4H2O.滴定时必须选用的仪器有________(从下图所列仪器中选填编号,同种仪器数量不限);滴定时是否需要加加指示剂?________.若需要,请指出加什么指示剂;若不需要,请说明理由.________.
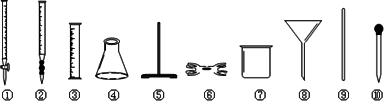
(3)取莫尔盐产品23.520 g,配成250 mL溶液,取出25.00 mL用0.0500 mol/L KMnO4溶液滴定,消耗KMnO4溶液19.50 mL,则产品中莫尔盐的质量分数________.
科目:gzhx 来源:0103 月考题 题型:计算题
科目:gzhx 来源: 题型:解答题
科目:gzhx 来源: 题型:阅读理解
 元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大.其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g•L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(其它参与反应的物质未列出):其中,均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;均含F元素的乙、丙、丁微粒间的转化全为氧化还原反应;相邻的乙与丙或丙与丁两两间均互不发生化学反应.请回答下列问题:
元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大.其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g•L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(其它参与反应的物质未列出):其中,均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;均含F元素的乙、丙、丁微粒间的转化全为氧化还原反应;相邻的乙与丙或丙与丁两两间均互不发生化学反应.请回答下列问题: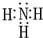
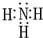
科目:gzhx 来源: 题型:阅读理解
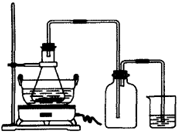 绿矾(FeSO4•7H2O)是重要的化学化工试剂,工业上常利用机械加工行业产生的废铁屑为原料制备.
绿矾(FeSO4•7H2O)是重要的化学化工试剂,工业上常利用机械加工行业产生的废铁屑为原料制备.| 序号 | 反应物用量 | 产品质量 |
| 1 | n(H2SO4):n(Fe)>1:1 | 介于Ⅰ级~Ⅱ级之间 |
| 2 | n(H2SO4):n(Fe)<1:1 | 优于Ⅰ级 |
科目:gzhx 来源: 题型:阅读理解
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:
| ||
| ||
科目:gzhx 来源: 题型:阅读理解
 (2009•广东模拟)绿矾(FeSO4•7H2O)是重要的化学化工试剂,工业上常利用机械加工行业产生的废铁屑为原料制备.请回答下列问题:
(2009•广东模拟)绿矾(FeSO4•7H2O)是重要的化学化工试剂,工业上常利用机械加工行业产生的废铁屑为原料制备.请回答下列问题:| 序号 | 反应物用量 | 产品质量 |
| 1 | n(H2SO4):n(Fe)>1:1 | 介于Ⅰ级~Ⅱ级之间 |
| 2 | n(H2SO4):n(Fe)<1:1 | 优于Ⅰ级 |