
科目:gzhx 来源:2015届吉林省高二上学期期末理科化学试卷(解析版) 题型:选择题
室温下,在0.01mol/L的Na2CO3溶液中,水的离子积常数(KW)为
A.1×10—14 B.大于1×10—14 C.小于1×10—14 D.无法确定
科目:gzhx 来源:2010-2011学年海南省海口市高三下学期高考调研测试(二)化学试卷 题型:选择题
常温下,在一定体积某浓度的BaCl2溶液中,逐滴加入pH=1的稀硫酸至溶液中的Ba2+恰好完全沉淀时,测得溶液pH=2。若忽略两溶液混合时的体积变化,则加入稀硫酸的体积与原BaCl2溶液的体积比是
A.10∶1 B.1∶10 C.9∶1 D.1∶9
科目:gzhx 来源: 题型:
A.Ba2++SO![]() ===BaSO4↓
===BaSO4↓
B.Al3++3OH-===Al(OH)3↓
C.Al3++4OH-===AlO![]() +2H2O
+2H2O
D.2Al3++3SO![]() +3Ba2++6OH-===3BaSO4↓+2Al(OH)3↓
+3Ba2++6OH-===3BaSO4↓+2Al(OH)3↓
E.Al3++2SO![]() +2Ba2++3OH-===2BaSO4↓+Al(OH)3↓
+2Ba2++3OH-===2BaSO4↓+Al(OH)3↓
F.Al3++2SO![]() +2Ba2++4OH-===2BaSO4↓+AlO
+2Ba2++4OH-===2BaSO4↓+AlO![]() +2H2O
+2H2O
请回答:
(1)Al3+完全沉淀时的离子方程式为_________________。(只选一个填写字母,下同)
(2)SO![]() 完全沉淀时的离子方程式为_________________________。
完全沉淀时的离子方程式为_________________________。
(3)沉淀达到最大量时,沉淀的总和为__________ mol,此时的离子方程式为______________。
(4)在硫酸钾、硫酸铝和明矾组成的混合溶液中,若c(SO![]() )为a mol·L-1,当滴加完等体积的b mol·L-1 KOH溶液时,反应过程中生成的沉淀恰好完全溶解,则原混合溶液中K+的物质的量浓度为__________ mol·L-1(用a、b表示)。
)为a mol·L-1,当滴加完等体积的b mol·L-1 KOH溶液时,反应过程中生成的沉淀恰好完全溶解,则原混合溶液中K+的物质的量浓度为__________ mol·L-1(用a、b表示)。
科目:gzhx 来源:2011届海南省海口市高三下学期高考调研测试(二)化学试卷 题型:单选题
常温下,在一定体积某浓度的BaCl2溶液中,逐滴加入pH=1的稀硫酸至溶液中的Ba2+恰好完全沉淀时,测得溶液pH=2。若忽略两溶液混合时的体积变化,则加入稀硫酸的体积与原BaCl2溶液的体积比是
| A.10∶1 | B.1∶10 | C.9∶1 | D.1∶9 |
科目:gzhx 来源: 题型:
常温下,在一定体积某浓度的BaCl2溶液中,逐滴加入pH=1的稀硫酸至溶液中的Ba2+恰好完全沉淀时,测得溶液pH=2。若忽略两溶液混合时的体积变化,则加入稀硫酸的体积与原BaCl2溶液的体积比是
A.10∶1 B.1∶10 C.9∶1 D.1∶9
科目:gzhx 来源:新课标 教材全解 高中化学 配人教版(必修1) 人教版 题型:022
硫酸铝钾是一种复盐,其电离方程式为:KAl(SO4)2![]() K++Al3++2
K++Al3++2![]() 向含a mol KAl(SO4)2的溶液中,逐滴加入Ba(OH)2溶液,过程中可能存在以下多个离子方程式:
向含a mol KAl(SO4)2的溶液中,逐滴加入Ba(OH)2溶液,过程中可能存在以下多个离子方程式:
A.Ba2++![]()
![]() BaSO4↓
BaSO4↓
B.Al3++3OH-![]() Al(OH)3↓
Al(OH)3↓
C.Al3++4OH-![]() AlO2-+2H2O
AlO2-+2H2O
D.2Al3++3![]() +3Ba2++6OH-
+3Ba2++6OH-![]() 3BaSO4↓+2Al(OH)3↓
3BaSO4↓+2Al(OH)3↓
E.Al3++2![]() +2Ba2++3OH-
+2Ba2++3OH-![]() 2BaSO4↓+Al(OH)3↓
2BaSO4↓+Al(OH)3↓
F.Al3++2![]() +2Ba2++4OH-
+2Ba2++4OH-![]() 2BaSO4↓+AlO2-+2H2O
2BaSO4↓+AlO2-+2H2O
请回答:
①Al3+完全沉淀时的离子方程式为________(只选一个,填写相应的字母,下同).
②![]() 完全沉淀时的离子方程式为________.
完全沉淀时的离子方程式为________.
③沉淀达到最大量时,沉淀的总和为________mol,此时的离子方程式为________
科目:gzhx 来源: 题型:
室温下,在25 mL0.1 mol/LNaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如右图所示,若忽略两溶液混合时的体积变化,有关粒子浓度关系比较错误的是
A.在A、B间任一点,溶液中一定都有:c(Na+)+c(H+)= c(CH3COO-)+c(OH-)
B.在B点:a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点:c(Na+)>c(CH3COO-) >c(H+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)=0.1mol/L
科目:gzhx 来源: 题型:
| ||
| ||
 H++R2O42-,HR2O4¯+H2O
H++R2O42-,HR2O4¯+H2O H2R2O4+OH¯,因两个平衡程度无法确定,故难以确定溶液酸碱性
H2R2O4+OH¯,因两个平衡程度无法确定,故难以确定溶液酸碱性 H++R2O42-,HR2O4¯+H2O
H++R2O42-,HR2O4¯+H2O H2R2O4+OH¯,因两个平衡程度无法确定,故难以确定溶液酸碱性
H2R2O4+OH¯,因两个平衡程度无法确定,故难以确定溶液酸碱性| O | - 4 |
| O | 2- 4 |
科目:gzhx 来源: 题型:
下列叙述正确的是
A.Na2CO3溶液加水稀释后,恢复至原温度,pH和KW均减小
B.在Na2S溶液中加入AgCl固体,溶液中的c(S2-)下降
C.室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性:
c(Na+)=c(SO42-)>c(NH4+) >c(OH-)=c(H+)
D.25℃时,pH=4.75,浓度均为0.1mol·L-1的CH3COOH、CH3COONa混合溶液:
c(CH3COO-) +c(OH-)<c(CH3COOH)+c(H+)
科目:gzhx 来源:2010-2011学年山西省临汾一中忻州一中长治二中高三第三次四校联考(理综)化学部 题型:选择题
下列叙述正确的是
A.Na2CO3溶液加水稀释后,恢复至原温度,pH和KW均减小
B.在Na2S溶液中加入AgCl固体,溶液中的c(S2-)下降
C.室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性:
c(Na+)=c(SO42-)>c(NH4+) >c(OH-)=c(H+)
D.25℃时,pH=4.75,浓度均为0.1mol·L-1的CH3COOH、CH3COONa混合溶液:
c(CH3COO-) +c(OH-)<c(CH3COOH)+c(H+)
科目:gzhx 来源:2009年山东省滨州市高考化学模拟试卷(解析版) 题型:解答题
 H++HR2O4-
H++HR2O4- H++R2O42-
H++R2O42-
 .
.科目:gzhx 来源: 题型:
(附加题)(共10分)(1)室温下取0.2mol·L-1HCl溶液与0.2mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
① 混合溶液中水电离出的c(H+)__________0.2mol·L-1 HCl溶液中电离出的c(H+);(填“>”、“<”、或“=”)
② 求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-) - c(M+) = ______________ mol·L-1
c(H+) - c(MOH) = _______________ mol·L-1
(2)室温下如果取0.2mol·L-1 MOH溶液与0.1 mol·L-1 HCl溶液等体积混合,测得混合溶液的pH<7,则说明MOH的电离程度________MCl的水解程度。(填“>”、“<”、或“=”),溶液中各离子浓度由大到小的顺序为______________
科目:gzhx 来源: 题型:
(8分)已知![]() 在水溶液中存在以上电离:
在水溶液中存在以上电离:
一级电离:![]() 二级电离:
二级电离:![]()
请回答一下问题:
(1)将0.1 mol・L-1的NaOH溶液与0.05 mol・L-1的![]() 溶液等体积混合,冷却至室温测得溶液的pH (填“等于7”、“大于7”或“小于7”)
溶液等体积混合,冷却至室温测得溶液的pH (填“等于7”、“大于7”或“小于7”)
(2)![]() 溶液 (填“呈酸性”、“呈碱性”或“无法确定”)。原因是
溶液 (填“呈酸性”、“呈碱性”或“无法确定”)。原因是
。
(3)某温度下,在0.1 mol・L-1的![]() 溶液中,以下关系一定不正确的是( )
溶液中,以下关系一定不正确的是( )
A ![]()
B Ph>1
C ![]()
科目:gzhx 来源:滨州模拟 题型:问答题
| ||
| ||
| O | -4 |
| O | 2-4 |
科目:gzhx 来源: 题型:单选题
科目:gzhx 来源:0110 模拟题 题型:不定项选择题
科目:gzhx 来源: 题型:
室温下,在25mL0.1mol•L-1 NaOH溶液中逐滴加入0.2 mol • L-1 CH3COOH溶液,pH 与滴加 CH3COOH 溶液体积的关系曲线如右图所示,若忽略两溶液混合时的体积变
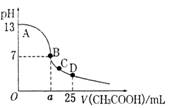 化,下列有关粒子浓度关系的说法错误的是
化,下列有关粒子浓度关系的说法错误的是
A.在A、B间任一点,溶液中一定都有
B.在B点:a>12.5,且有
C.在C点:
D..在D点:
科目:gzhx 来源: 题型:多选题
科目:gzhx 来源: 题型:
下列叙述正确的是
A.Na2CO3溶液加水稀释后,恢复至原温度,pH和KW均减小
B.在Na2S溶液中加入AgCl固体,溶液中的c(S2-)下降
C.室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性:
c(Na+)=c(SO42-)>c(NH4+) >c(OH-)=c(H+)
D.25℃时,pH=4.75,浓度均为0.1mol·L-1的CH3COOH、CH3COONa混合溶液:
c(CH3COO-) +c(OH-)<c(CH3COOH)+c(H+)
科目:gzhx 来源: 题型:
下列叙述正确的是
A.Na2CO3溶液加水稀释后,恢复至原温度,pH和KW均减小
B.在Na2S溶液中加入AgCl固体,溶液中的c(S2-)下降
C.室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性:
c(Na+)=c(SO42-)>c(NH4+) >c(OH-)=c(H+)
D.25℃时,pH=4.75,浓度均为0.1mol·L-1的CH3COOH、CH3COONa混合溶液:
c(CH3COO-) +c(OH-)<c(CH3COOH)+c(H+)