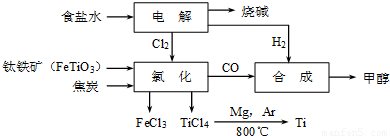
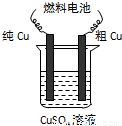
科目:gzhx 来源: 题型:单选题
将8mol H2和2mol N2充入2L密闭容器中,在一定条件下进行合成氨反应,4min后反应达到平衡,测得容器中还有5.6mol H2。
下列计算结果错误的是
科目:gzhx 来源:2004全国各省市高考模拟试题汇编·化学 题型:013
将8mol H2和2mol N2充入2L密闭容器中,在一定条件下进行合成氨反应,4min后反应达到平衡,测得容器中还有5.6mol H2.下列计算结果错误的是
[ ]
A.v(H2)=0.3mol·L-1·min-1
B.H2的转化率为25%
C.NH3的物质的量浓度为0.8mol·L-1
D.NH3的体积分数为19.05%
科目:gzhx 来源: 题型:单选题
科目:gzhx 来源: 题型:单选题
科目:gzhx 来源: 题型:
 CH3OH(气),6s体系达平衡,此容器压强为开始时的0.6倍.试求:①v(H2)=
CH3OH(气),6s体系达平衡,此容器压强为开始时的0.6倍.试求:①v(H2)=科目:gzhx 来源: 题型:

科目:gzhx 来源: 题型:
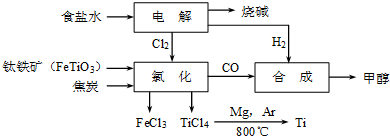
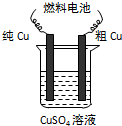
科目:gzhx 来源: 题型:
 2Z(g)+a Q(g);△H=b kJ/mol.达到平衡时生成0.8mol Z,测得Q的浓度为0.4mol/L,下列叙述正确的是( )
2Z(g)+a Q(g);△H=b kJ/mol.达到平衡时生成0.8mol Z,测得Q的浓度为0.4mol/L,下列叙述正确的是( )科目:gzhx 来源: 题型:

科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:阅读理解
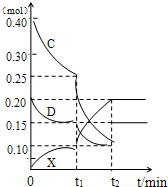 (2009•合肥三模)A、B、C、D、E是中学常见的单质,X是化合物.A为金属,原子最外层p轨道上只有一个电子,可与NaOH溶液反应;B是常见的金属,其基态原子的外围电子排布式为3d64s2;常温下C是气态非金属单质,可以燃烧;D是空气主要成分之一,可与C发生重要工业反应生成X;E是固体非金属单质,在氧气中燃烧时有明亮的蓝紫色火焰.根据上述物质的信息,回答下列有关问题:
(2009•合肥三模)A、B、C、D、E是中学常见的单质,X是化合物.A为金属,原子最外层p轨道上只有一个电子,可与NaOH溶液反应;B是常见的金属,其基态原子的外围电子排布式为3d64s2;常温下C是气态非金属单质,可以燃烧;D是空气主要成分之一,可与C发生重要工业反应生成X;E是固体非金属单质,在氧气中燃烧时有明亮的蓝紫色火焰.根据上述物质的信息,回答下列有关问题:| c2(NH3) |
| c(N2)•c3(H2) |
| c2(NH3) |
| c(N2)•c3(H2) |
科目:gzhx 来源: 题型:
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
科目:gzhx 来源: 题型:阅读理解
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
科目:gzhx 来源: 题型:阅读理解
 .
.
| ||
| ||
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
科目:gzhx 来源:2011-2012学年天津市高三寒假验收考试化学试卷 题型:选择题
.一定温度下,将4mol PCl3和2mol Cl2充入容积不变的密闭容器中,在一定条件下反应:
 ,各物质均为气态。达平衡后,PCl5为0.8mol。若此时再移走2molPCl3和lmolCl2,相同温度下达到平衡,PCl5的物质的量为 ( )
,各物质均为气态。达平衡后,PCl5为0.8mol。若此时再移走2molPCl3和lmolCl2,相同温度下达到平衡,PCl5的物质的量为 ( )
A.0.8mol B.0.4mol C. 0.4mol<x<0.8mol D.<0.4mol
科目:gzhx 来源:2012-2013学年浙江省兰溪一中、东阳中学联考高二(下)期中化学试卷(解析版) 题型:填空题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
科目:gzhx 来源:2010-2011学年四川省成都市双流中学高三(下)月考化学试卷(2月份)(解析版) 题型:选择题
 2Z(g)+a Q(g);△H=b kJ/mol.达到平衡时生成0.8mol Z,测得Q的浓度为0.4mol/L,下列叙述正确的是( )
2Z(g)+a Q(g);△H=b kJ/mol.达到平衡时生成0.8mol Z,测得Q的浓度为0.4mol/L,下列叙述正确的是( )科目:gzhx 来源:2011年江苏省泰州市姜堰市高考化学二模试卷(解析版) 题型:填空题