
科目:gzhx 来源:桂壮红皮书·高中同步系列·活题巧解巧练·高一化学(上) 题型:038
表中是四种盐在不同温度下的溶解度(g).(计算时假定:①盐类共存时不影响各自的溶解度;②过滤晶体时,溶剂损耗忽略不计)
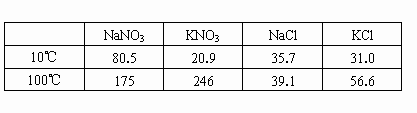
(1)取23.4g NaCl和40.4g KNO3,加70.0g H2O,加热溶解.在100℃时蒸发掉50.0g H2O,维持该温度过滤析出晶体,计算所得晶体的质量(m高温).将滤液冷却至10℃,待充分结晶后,过滤,计算所得晶体质量(m低温).
(2)另取34.0g NaNO3和29.8g KCl,同样进行如上实验.10℃时析出的晶体是________(写出化学式).100℃和10℃得到晶体质量( m和
m和 )分别是多少?
)分别是多少?
科目:czhx 来源: 题型:阅读理解
| 温度 盐 溶解度 |
10℃ | 20℃ | 30℃ | 40℃ | 50℃ |
| NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NH4HCO3 | 15.8 | 21.0 | 27.0 | ------ | ------ |
| NaHCO3 | 8.1 | 9.6 | 11.1 | 12.7 | ---- |
| NH4Cl | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
科目:czhx 来源: 题型:阅读理解
| 温度 盐 溶解度 |
10℃ | 20℃ | 30℃ | 40℃ | 50℃ |
| NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NH4HCO3 | 15.8 | 21.0 | 27.0 | ------ | ------ |
| NaHCO3 | 8.1 | 9.6 | 11.1 | 12.7 | ---- |
| NH4Cl | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
科目:gzhx 来源:2013-2014学年上海市高三上学期期中考试化学试卷(解析版) 题型:填空题
下表是四种盐在不同温度下的溶解度(g/100g水):
|
|
NaNO3 |
KNO3 |
NaCl |
KCl |
|
10℃ |
80.5 |
21.2 |
35.7 |
31.0 |
|
100℃ |
175 |
246 |
39.1 |
56.6 |
(假设:盐类共存时不影响各自的溶解度,分离晶体时,溶剂的损耗忽略不计)
某同学设计用物质的量之比为1∶1的硝酸钠和氯化钾为原料,加入一定量的水制取硝酸钾的实验,其流程如下图所示:

(1)在①和②的实验过程中,需要控制的关键的实验条件是______________________,在上述晶体中,______(填“A”或“C”)应为硝酸钾晶体。
(2)在①的实验过程中,需要进行的操作依次是________________、________________、_____________。
(3)粗产品中可能含有杂质离子_______________________,检验其中一种离子的方法是________________________________________________________________________。
(4)为了洗涤所得的硝酸钾晶体,下列溶剂可用作洗涤剂的是___________(填编号)。
a.热水 b.冰水 c.95%的酒精 d.四氯化碳
(5)如取34.0g硝酸钠和29.8g氯化钾,加入70g水,在100℃蒸发掉50g水,维持该温度,过滤,析出晶体的质量为_______________。
科目:czhx 来源:2007年威海市初中毕业升学统一考试 化学试题 题型:058
| |||||||||||||||||||||||||||||
科目:czhx 来源: 题型:解答题
| 温度 盐 溶解度 | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ |
| NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NH4HCO3 | 15.8 | 21.0 | 27.0 | ------ | ------ |
| NaHCO3 | 8.1 | 9.6 | 11.1 | 12.7 | ---- |
| NH4Cl | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
科目:gzhx 来源:高中化学习题1 题型:022
下表是四种盐在不同温度下的溶解度(g/100g![]() ):
):

(假设:①盐类共存时不影响各自的溶解度;②分离晶体时,溶剂的损耗忽略不计)某同学设计用物质的量比为1∶1的硝酸钠和氯化钾为原料,加入一定量的水制取硝酸钾的实验,其流程如下图:
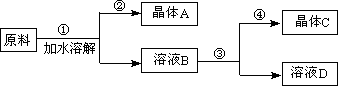
(1)在①和③的实验过程中,实验的关键条件是________;
(2)分离出晶体的②和④的操作是________(填“倾倒”、“蒸发”、“结晶”或“过渡”),硝酸钾是晶体________(填“A”或“C”);
(3)粗产品中可能含有的杂质离子是________,检验的方法是___________________________;
(4)欲将粗产品提纯,可采用的方法是________.
科目:czhx 来源: 题型:阅读理解
追踪科学家的足迹
材料1:纯碱的产量是衡量一个国家化学工业发展水平的重要指标。下面是实验室摸拟侯氏制碱法生产原理的主要过程:
(1)20℃时,向浓氨水中通入足量的二氧化碳得到NH4HCO3饱和溶液;
②向NH4HCO3饱和溶液中加入食盐细粒,并不断搅拌,直到NaHCO3结晶析出完毕;
③将析出的晶体过滤,得到晶体和滤液,洗涤晶体,然后将晶体放在试管中充分加热,得到Na2CO3;
④向③的滤液中加入食盐细粒,析出NH4CI晶体,过滤,得到NH4CI。
材料2:四种盐在不同温度下的溶解度表。
|
盐 溶解度 | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ |
| NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NH4HCO3 | 15.8 | 21.0 | 27.0 | ------ | ------ |
| NaHCO3 | 8.1 | 9.6 | 11.1 | 12.7 | ---- |
| NH4CI | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
试回答下列问题:
(1)在实验室中,你选择的制备C02反应的化学方程式为 。在工业生产中,要获得生产纯碱的原料CO2 你认为最经济实用的方法是以 为原料,该反应的化学方程式为 。
(2)有人认为侯氏制碱法有以下优点,你认为其中正确的是 。
A.生产过程中部分反应产物可作为原料循环使用
B.副产品是一种氮肥
C.反应都不需要加热,可节约能源
(3)检验③中的白色粉末中是否含有氯化钠的方法是 。
(4)在②中,随着食盐的逐渐加入,溶液变成了NH4HCO3和NaCl的混合溶液,析出晶体之前,混合溶液中存在的离子有(用离子符号表示,下同。) 。在③中,将析出的晶体过滤后,溶液中数量减少的离子有 ;滤液中仍然存在的离子有 。②中反应的化学方程式为 。
(5)在20 ℃时,向含NH4HC03 21 g的饱和溶液中加入足量食盆。试通过计算说明,随着食盐的逐渐加入,为什么会有NaHC03晶体析出,而没有NH4CI晶休析出?理论上能析出多少克NaHCO3?(友情提示:本小题没有计算过程不得分.可能用到的相对分子质量:NH4HC03: 79; NaCl: 58.5; NaHC03: 84-, NH4CI: 53.5)。
科目:gzhx 来源:物理教研室 题型:038
|
|
NaNO3 |
KNO3 |
NaCl |
KCl |
|
10℃ |
80.5 |
20.9 |
35.7 |
31.0 |
|
100℃ |
175 |
246 |
39.1 |
56.6 |
(计算时假定:①盐类共存时不会影响各自的溶解度;②过滤晶体时,溶剂损耗忽略不计)
(1)取23.4 g NaCl和40.4 g KNO3,加入70.0 g水,加热溶解.在100℃时,蒸发掉50.0 g水,维持该温度,过滤析出晶体,计算所得晶体的质量(m高温),将滤液冷却至10℃,待充分结晶后,过滤.计算所得晶体的质量(m低温).
(2)另取34.0 g NaNO3和29.8 g KCl
| NaNO3 | KNO3 | NaCl | KCl | |
| 10°C | 80.5 | 20.9 | 35.7 | 31.0 |
| 100°C | 175 | 246 | 39.1 | 56.6 |
科目:gzhx 来源: 题型:阅读理解
 本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应和答题区域内作答.若两题都做,则按A题评分.
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应和答题区域内作答.若两题都做,则按A题评分.
| 电离能/kJ•mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
| NaNO3 | KNO3 | NaCl | KCl | |
| 10℃ | 80.5 | 20.9 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |
科目:gzhx 来源: 题型:阅读理解
| 温度溶解度盐 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | -① | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
| c(V2-V1)M |
| 1000W |
| c(V2-V1)M |
| 1000W |
科目:czhx 来源: 题型:
| 1 |
| 3 |
| 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| 碳酸氢铵 | 15.8 | 21.0 | 27.0 | ||
| 碳酸氢钠 | 8.1 | 9.6 | 11.1 | 12.7 | |
| 氯化铵 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
科目:czhx 来源: 题型:阅读理解
温度 溶解度 盐 |
0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | ① | -- | -- | -- |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | -- |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
| ||
科目:czhx 来源: 题型:
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | |
| NaCl | 35.7 | 35.8 | 36 | 36.3 | 36.6 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | - |
| NaHCO3 | 6.9 | 8.2 | 9.6 | 11.1 | 12.7 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 |