科目:gzhx 来源: 题型:

| 1 |
| 2 |
| 1 |
| 2 |
| ||
| ||
科目:gzhx 来源:2012届福建省三明市普通高中高三上学期联合命题考试化学试卷 题型:填空题
(10分)(1)常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
①写出酸H2A的电离方程式__________________________。
②若溶液M由2 mol·L-1NaHA溶液与2mol·L-1NaOH溶液等体积混合而得,则溶液M的pH ____7 (填“>”、“<”或“=”);溶液M中各微粒的浓度关系正确的是 。
A.c(Na+)>c(A2-)>c(OH-) >c(H+)
B. c(HA-) +c(H2A) +c(H+)=c(OH-)
C.c(A2-)+c(HA-) +c(H2A)=1 mol·L-1
D. c(A2-)+c(HA-)+c(OH-)=c(Na+)+c(H+)
(2)室温时,氢氧化钙的溶度积KSP =4.7×10-6, 室温时将9 mL0.02 mol·L—1的氯化钙溶液与1 mL pH=13的氢氧化钠溶液混合后(溶液体积可直接加和),溶液中___ 沉淀析出(填“有”或“无”)。
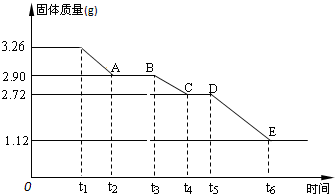
(3) 某校课外活动小组为测定已部分脱水的生石膏的组成(xCaSO4·yH2O),做如下实验:将固体加热,经测量剩余固体质量随时间变化如图所示。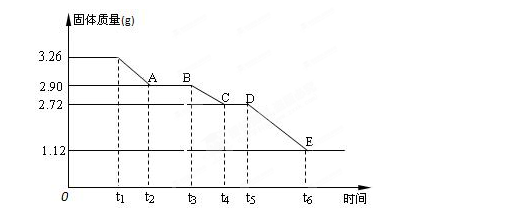
则x:y= 。t2~t3时间段固体的化学式为 。t5~t6时间段固体质量减轻的原因是产生了两种气体,其中一种能使品红溶液褪色。则该时间所发生反应的化学方程式为 。
科目:gzhx 来源: 题型:
(10分)(1)常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
①写出酸H2A的电离方程式__________________________。
②若溶液M由2 mol·L-1NaHA溶液与2mol·L-1NaOH溶液等体积混合而得,则溶液M的pH ____7 (填“>”、“<”或“=”);溶液M中各微粒的浓度关系正确的是 。
A.c(Na+)>c(A2-)>c(OH-)>c(H+)
B.c(HA-) +c(H2A) +c(H+)=c(OH-)
C.c(A2-)+c(HA-)+c(H2A)=1 mol·L-1
D. c(A2-)+c(HA-)+c(OH-)=c(Na+)+c(H+)
(2)室温时,氢氧化钙的溶度积KSP =4.7×10-6, 室温时将9 mL0.02 mol·L—1的氯化钙溶液与1 mL pH=13的氢氧化钠溶液混合后(溶液体积可直接加和),溶液中___ 沉淀析出(填“有”或“无”)。
(3) 某校课外活动小组为测定已部分脱水的生石膏的组成(xCaSO4·yH2O),做如下实验:将固体加热,经测量剩余固体质量随时间变化如图所示。
则x:y= 。t2~t3时间段固体的化学式为 。t5~t6时间段固体质量减轻的原因是产生了两种气体,其中一种能使品红溶液褪色。则该时间所发生反应的化学方程式为 。
科目:gzhx 来源:2011-2012学年福建省高三第一学期联合命题考试化学试卷 题型:填空题
(10分)(1)常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
①写出酸H2A的电离方程式__________________________。
②若溶液M由2 mol·L-1NaHA溶液与2mol·L-1NaOH溶液等体积混合而得,则溶液M的pH ____7 (填“>”、“<”或“=”);溶液M中各微粒的浓度关系正确的是 。
A.c(Na+)>c(A2-)>c(OH-) >c(H+)
B. c(HA-) +c(H2A) +c(H+)=c(OH-)
C.c(A2-)+c(HA-) +c(H2A)=1 mol·L-1
D. c(A2-)+c(HA-)+c(OH-)=c(Na+)+c(H+)
(2)室温时,氢氧化钙的溶度积KSP =4.7×10-6, 室温时将9 mL0.02 mol·L—1的氯化钙溶液与1 mL pH=13的氢氧化钠溶液混合后(溶液体积可直接加和),溶液中___ 沉淀析出(填“有”或“无”)。
(3) 某校课外活动小组为测定已部分脱水的生石膏的组成(xCaSO4·yH2O),做如下实验:将固体加热,经测量剩余固体质量随时间变化如图所示。
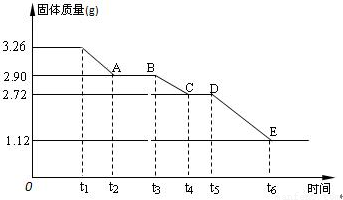
则x:y= 。t2~t3时间段固体的化学式为 。t5~t6时间段固体质量减轻的原因是产生了两种气体,其中一种能使品红溶液褪色。则该时间所发生反应的化学方程式为 。
科目:gzhx 来源: 题型:
(10分)(1)常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
①写出酸H2A的电离方程式__________________________。
②若溶液M由2 mol·L-1NaHA溶液与2mol·L-1NaOH溶液等体积混合而得,则溶液M的pH ____7 (填“>”、“<”或“=”);溶液M中各微粒的浓度关系正确的是 。
A.c(Na+)>c(A2-)>c(OH-)>c(H+)
B. c(HA-)+c(H2A) +c(H+)=c(OH-)
C.c(A2-)+c(HA-)+c(H2A)=1mol·L-1
D. c(A2-)+c(HA-)+c(OH-)=c(Na+)+c(H+)
(2)室温时,氢氧化钙的溶度积KSP=4.7×10-6, 室温时将9 mL0.02 mol·L—1的氯化钙溶液与1 mL pH=13的氢氧化钠溶液混合后(溶液体积可直接加和),溶液中___ 沉淀析出(填“有”或“无”)。
(3) 某校课外活动小组为测定已部分脱水的生石膏的组成(xCaSO4·yH2O),做如下实验:将固体加热,经测量剩余固体质量随时间变化如图所示。
则x:y= 。t2~t3时间段固体的化学式为 。t5~t6时间段固体质量减轻的原因是产生了两种气体,其中一种能使品红溶液褪色。则该时间所发生反应的化学方程式为 。
科目:gzhx 来源:2011-2012学年福建省三明市高三上学期联合命题考试化学试卷 题型:填空题
(10分)(1)常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
①写出酸H2A的电离方程式__________________________。
②若溶液M由2 mol·L-1NaHA溶液与2mol·L-1NaOH溶液等体积混合而得,则溶液M的pH ____7 (填“>”、“<”或“=”);溶液M中各微粒的浓度关系正确的是 。
A.c(Na+)>c(A2-)>c(OH-) >c(H+)
B. c(HA-) +c(H2A) +c(H+)=c(OH-)
C.c(A2-)+c(HA-) +c(H2A)=1 mol·L-1
D. c(A2-)+c(HA-)+c(OH-)=c(Na+)+c(H+)
(2)室温时,氢氧化钙的溶度积KSP =4.7×10-6, 室温时将9 mL0.02 mol·L—1的氯化钙溶液与1 mL pH=13的氢氧化钠溶液混合后(溶液体积可直接加和),溶液中___ 沉淀析出(填“有”或“无”)。
(3) 某校课外活动小组为测定已部分脱水的生石膏的组成(xCaSO4·yH2O),做如下实验:将固体加热,经测量剩余固体质量随时间变化如图所示。
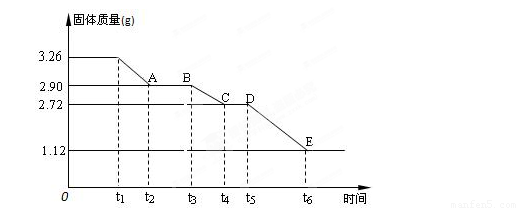
则x:y= 。t2~t3时间段固体的化学式为 。t5~t6时间段固体质量减轻的原因是产生了两种气体,其中一种能使品红溶液褪色。则该时间所发生反应的化学方程式为 。
科目:gzhx 来源: 题型:
硫酸钙是一种用途非常广泛的产品。
(1)25℃时,Ksp(CaSO4)=7.10×10-5。在1L0.1mol·L-1CaCl2溶液中加入1L0.2mol·L-1的Na2SO4溶液,充分反应后(假设混合后溶液的体积变化忽略不计)溶液中Ca2+物质的量的浓度为 ▲ mol·L-1。
(2)某校课外活动小组为测定已部分脱水的生石膏的组成(xCaSO4·yH2O),做如下实验:将固体放在坩埚中加热,经测量剩余固体质量随时间变化如图所示。
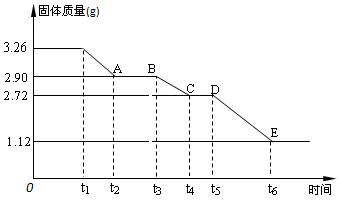
x :y =____▲_____。
② t2~t3时间段固体的化学式为 ▲ 。
③ t5~t6时间段固体质量减轻的原因是产生了两种气体,其中一种能使品红溶液褪色,则该时间段所发生反应的化学方程式为 。
科目:gzhx 来源:2011届江苏省宿豫中学高三第二次模拟考试化学试卷 题型:填空题
硫酸钙是一种用途非常广泛的产品。
(1)25℃时,Ksp(CaSO4)=7.10×10-5。在1L0.1mol·L-1CaCl2溶液中加入1L0.2mol·L-1的Na2SO4溶液,充分反应后(假设混合后溶液的体积变化忽略不计)溶液中Ca2+物质的量的浓度为 ▲ mol·L-1。
(2)某校课外活动小组为测定已部分脱水的生石膏的组成(xCaSO4·yH2O),做如下实验:将固体放在坩埚中加热,经测量剩余固体质量随时间变化如图所示。
① x :y =____▲_____。
② ② t2~t3时间段固体的化学式为 ▲ 。
③ t5~t6时间段固体质量减轻的原因是产生了两种气体,其中一种能使品红溶液褪色,则该时间段所发生反应的化学方程式为 。
科目:gzhx 来源:江苏省宿豫中学2011届高三第二次模拟考试化学试题 题型:022
硫酸钙是一种用途非常广泛的产品.
(1)25℃时,Ksp(CaSO4)=7.10×10-5.在1 L 0.1 mol·L-1 CaCl2溶液中加入1 L 0.2 mol·L-1的Na2SO4溶液,充分反应后(假设混合后溶液的体积变化忽略不计)溶液中Ca2+物质的量的浓度为________mol·L-1.
(2)某校课外活动小组为测定已部分脱水的生石膏的组成(xCaSO4·yH2O),做如下实验:将固体放在坩埚中加热,经测量剩余固体质量随时间变化如图所示.
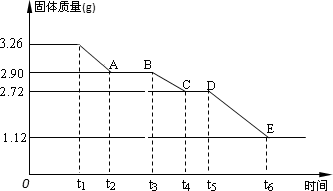
①x∶y=________.
②t2~t3时间段固体的化学式为________.
③t5~t6时间段固体质量减轻的原因是产生了两种气体,其中一种能使品红溶液褪色,则该时间段所发生反应的化学方程式为________.
科目:gzhx 来源:镇江一模 题型:问答题
科目:gzhx 来源: 题型:
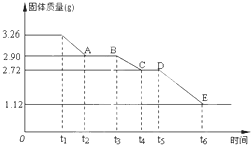 某校课外活动小组为测定已部分脱水的生石膏的组成(xCaSO4•yH2O),做如下实验:将固体加热,经测量剩余固体质量随时间变化如图所示.下列说法错误的是( )
某校课外活动小组为测定已部分脱水的生石膏的组成(xCaSO4•yH2O),做如下实验:将固体加热,经测量剩余固体质量随时间变化如图所示.下列说法错误的是( )| A、t5~t6时间段固体质量减轻的原因是产生了SO2、O2两种气体 | B、t6后得到的固体是CaSO4 | C、t2~t3时间段固体的化学式为2CaSO4•H2O | D、x:y=2:3 |
科目:gzhx 来源: 题型:阅读理解
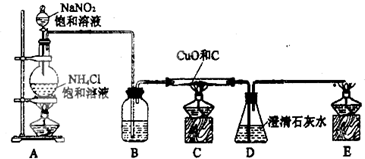
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
科目:gzhx 来源: 题型:
某化学课外活动小组为了探究不同催化剂对氧化氢分解速率的影响,设计并进行了如下实验,请你完成下列各项任务。
I.氧化铜的制备。
(1)称取10g胆矾,将其放入小烧杯中,再溶于适量水配成溶液。
(2)向步骤(1)中的烧杯内滴加NaOH溶液,直至产生大量的沉淀。
(3)检验沉淀是否完全,其操作方法是 。
(4)将步骤(2)所得混合物加热至沉淀全部变为黑色。
(5)再将步骤(4)所得混合物 、洗涤、 后研细。本步骤中要验证是否洗净硫酸根离子的方法是: 。
II.比较不同催化剂对过氧化氢分解速率的影响。
该课外活动小组拟完成的实验及实验记录的表格如下,
拟采用下图所示装置来测定氧气的体积。
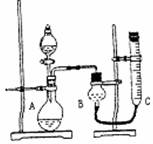
| 实验序号 | 双氧水体积 | 催化剂 | 待测数据 |
| ① | 15mL | 无 | |
| ② | 15mL | CuO(0.5g) | |
| ③ | 15mL | MnO2(0.5g) |
试回答下列问题:
(1)本实验中影响双氧水分解速率的因素有:①实验时的温度和压强;②双氧水的浓度
③不同的催化剂;④ ;⑤ 等。
(2)上述实验中的“待测数据”可以是 ;也可以是 。
(3)为探究CuO在实验②中是否起催化作用,除与①比较外,还需补做下列实验(不必写具体操作):①证明CuO的化学性质没有改变;② 。
(4)你认为可以使过氧化氢分解的催化剂还有 (填一种物质的化学式或名称)。
科目:gzhx 来源: 题型:阅读理解
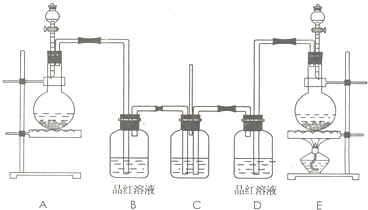
| ||
| ||
科目:gzhx 来源:2010年湖北省武汉市武昌区高三五月调研测试理综化学试题 题型:填空题
(15分)硫酸亚铁药片(外表包有一层特质的糖衣)是一种治疗铁性贫血的药剂。某化学课外活动小组为测定其中硫酸亚铁的含量,进行如下实验:
I.甲同学要测定其中铁元素含量,实验按以下步骤进行: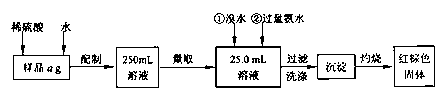
请根据上面流程,回答以下问题:
(1)刮除药片的糖衣,甲同学如下称得样品ag,则你认为a=_____。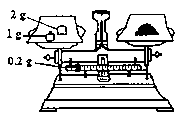
(2)将其碾碎后迅速溶解,配制250mL溶液。配制溶液时除烧杯、玻璃棒、量筒、250mL容量瓶外,还必须有的玻璃仪器__________。
(3)洗涤沉淀的操作是_____________________________________________。
(4)将沉淀物加热,冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3g,据此结果,还应进行的操作是________________________________________。
根据测得的数据可计算出硫酸亚铁的含量。
II、乙同学根据反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O,采用滴定的方法测定其中硫酸亚铁的质量分数。
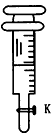
(5)取上述甲同学所配置的待测液25.00mL置于锥形瓶中,并将0.02mol/L KMnO4的标准溶液装入_____(“酸式”或“碱式”)滴定管中,调节液面至“0”刻度。
(6)滴定操作时,眼睛注视_________________________。
(7)滴定待测液至终点,如此滴定三次,实验数据如下表所示:
(其中第一次滴定给点的数据如右图,请你你读得的数据填入表中)
样品中硫酸亚铁的质量分数为_____。(保留3位有效数字)
科目:gzhx 来源: 题型:阅读理解
硫酸亚铁药片(外表包有一层特质的糖衣)是一种治疗铁性贫血的药剂。某化学课外活动小组为测定其中硫酸亚铁的含量,进行如下实验:
I.甲同学要测定其中铁元素含量,实验按以下步骤进行:
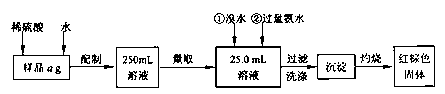
请根据上面流程,回答以下问题:
(1)刮除药片的糖衣,甲同学如下称得样品ag,则你认为a=_____。
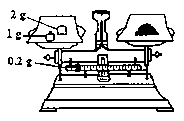
(2)将其碾碎后迅速溶解,配制250mL溶液。配制溶液时除烧杯、玻璃棒、量筒、250mL容量瓶外,还必须有的玻璃仪器__________。
(3)洗涤沉淀的操作是_____________________________________________。
(4)将沉淀物加热,冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3g,据此结果,还应进行的操作是________________________________________。
根据测得的数据可计算出硫酸亚铁的含量。
II、乙同学根据反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O,采用滴定的方法测定其中硫酸亚铁的质量分数。
(5)取上述甲同学所配置的待测液25.00mL置于锥形瓶中,并将0.02mol/L KMnO4的标准溶液装入_____(“酸式”或“碱式”)滴定管中,调节液面至“0”刻度。
(6)滴定操作时,眼睛注视_________________________。
(7)滴定待测液至终点,如此滴定三次,实验数据如下表所示:
(其中第一次滴定给点的数据如右图,请你你读得的数据填入表中)
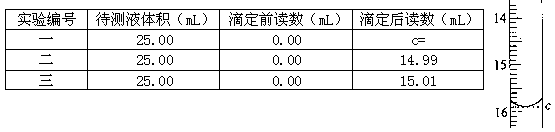
样品中硫酸亚铁的质量分数为_____。(保留3位有效数字)
科目:gzhx 来源:知识精讲与能力训练 高三化学 题型:013
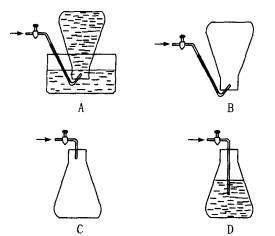
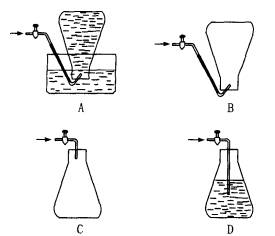
某化学课外活动小组为测定某厂生产的液化石油气(设该液化石油气由丁烷和丙烷组成)的平均相对分子质量,在实验中需收集该混合气体样品,下列收集方法中正确的是
[ ]

科目:gzhx 来源:专项题 题型:实验题
科目:gzhx 来源:物理教研室 题型:013
科目:gzhx 来源: 题型:013
某化学课外活动小组为测定某厂生产的液化石油气(设该液化石油气由丁烷和丙烷组成)的平均相对分子质量,在实验中需收集该混合气体样品,下列收集方法正确的是…( )