科目:czhx 来源: 题型:

科目:gzhx 来源: 题型:阅读理解

| 45c |
| 56a |
| 45c |
| 56a |
科目:czhx 来源:2013-2014江苏省无锡市南长区九年级二模化学试卷(解析版) 题型:填空题
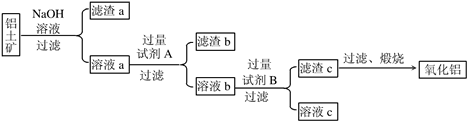
(5分)我国是铝生产大国,铝生产是以铝土矿为原料,经过纯制和电解过程生产而
成,以下是生产铝的主要工艺流程及工艺介绍。
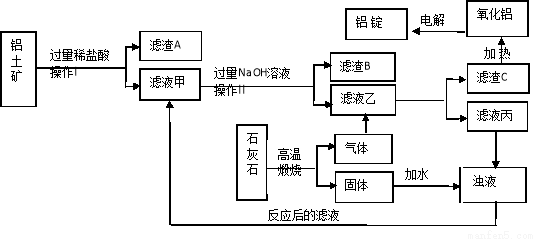
纯制工艺:就是先将铝土矿(主要成分是Al2O3,含有Fe2O3、MgCO3等杂质)分别用稀盐酸和氢氧化钠溶液溶解,去除杂质和获得偏铝酸钠溶液,然后向偏铝酸钠溶液中通入过量的CO2以便得到高纯度的Al(OH)3。
电解工艺:通电分解由Al(OH)3加热分解而成的Al2O3 。
根据以上图解和介绍,请回答下列相关问题:
(1)生产流程中的操作Ⅰ、Ⅱ名称是 。
(2)铝土矿中加入过量稀盐酸会发生多个反应,其中的一个反应的化学方程式是 。
(3)滤液甲、滤液乙分别于NaOH和CO2反应的化学方程式是: 4NaOH+AlCl3=X(偏铝酸钠)+3NaCl+2H2O、 2X+CO2+3H2O=2Al(OH)3↓+Na2CO3 这两个化学方程式中X的化学式为 。
(4)最终制得铝的化学方程式是 。
(5)为节约成本减少浪费整个生产流程中可进行循环使用的主要物质是
科目:gzhx 来源:2016届广东省英德市高三上学期第二次月考理综化学试卷(解析版) 题型:实验题
工业中以铝土矿(主要成分为Al2O3,另含有Fe2O3和SiO2)为原料冶炼铝过程如下图所示。
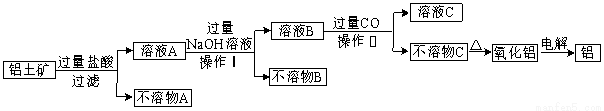
试回答下列问题:
(1)实验室进行过滤用到的玻璃仪器有烧杯、________、________。
(2)操作II中生成不溶物C的离子方程式是 。
(3)氧化铝的熔点高达2050℃,工业上为降低能耗,在铝的电解冶炼时,采取的措施是 。
(4)电解冶炼铝时,阳极和阴极以碳素材料制成,电解过程中,阳极材料需定期进行更换,原因是 。
(5)为了提高综合经济效益,实际工业生产中常将上述反应中的相关物质循环利用。其部分转化关系如下图所示:

①上述转化中未涉及四种基本反应类型中的 反应;
②写出过程③的化学方程式: 。
(6)科学研究表明,人体过量吸入铝元素会严重危害身体健康。请你结合实际提出两条杜绝铝元素过量吸入的措施:____________。
科目:gzhx 来源: 题型:解答题
 4AlCl3+3O2↑.回答以下问题:
4AlCl3+3O2↑.回答以下问题: AlCl3+X↑,设计实验确定气体X的成分:______.
AlCl3+X↑,设计实验确定气体X的成分:______.
科目:gzhx 来源: 题型:解答题

科目:gzhx 来源: 题型:
| ||
| △ |

科目:gzhx 来源: 题型:

| ||
| ||
| ||
| ||
| ||
| ||
| ||
| 冰晶石 |
| ||
| 冰晶石 |
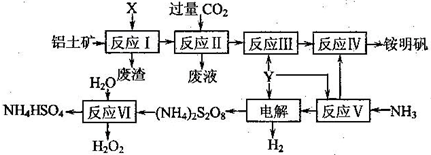
科目:gzhx 来源:江苏省南京市白下区2011届高三二模化学试题 题型:022
铝土矿的主要成分为Al2O3.生产铵明矾[NH4Al(SO4)2·12H2O]和H2O2的工艺流程图如下.
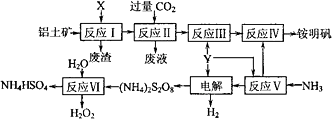
(1)流程图中X为________(填化学式)溶液.
(2)反应Ⅱ的离子方程式为________.
(3)“电解”时,用惰性材料作电极,则阴极反应可表示为________.
(4)反应Ⅵ的化学方程式为________.
(5)流程中可以循环使用的物质是________.
科目:gzhx 来源:广东省2009届高三化学各地名校月考试题汇编-镁铝及其化合物 题型:022
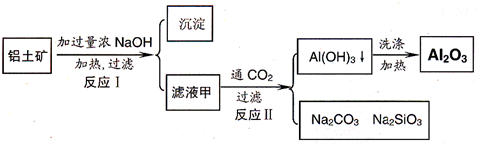
铝土矿(主要成分为Al2O3、SiO2、Fe2O3)是提取氧化铝的原料.提取氧化铝的工艺流程如下:
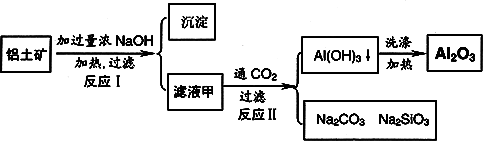
(1)滤液甲的主要成分是(写化学式)________
(2)写出反应Ⅱ的离子方程式:________
(3)结合反应Ⅱ,判断下列微粒结合质子(H+)的能力,由强到弱的顺序是________(填字母序号)
a.AlO2―或[Al(OH)4]-
b.OH―
c.SiO32―
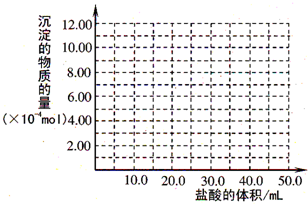
(4)取滤液甲少许,加入过量盐酸,过滤;再用惰性电极电解其滤液,两极均有气体产生,且全部逸出,在阴极区还有沉淀生成,最后沉淀消失.沉淀消失的原因可用离子方程式表示为:________
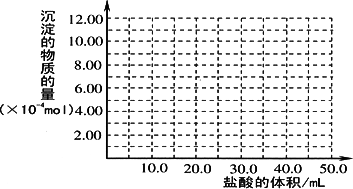
(5)取(4)电解以后的溶液10.0 mL,经分析,该溶液中只含有两种等物质的量浓度的碱性溶质,向其中逐滴加入0.100 mol·L-1盐酸溶液,当加入50.0 mL盐酸溶液时,生成的沉淀恰好溶解.
①加入50.0 mL盐酸溶液发生的离子反应的先后顺序依次为:________.
②请画出生成沉淀的物质的量与加入盐酸体积的关系图.
科目:gzhx 来源:2015届福建省高三上学期期中质量检测化学试卷(解析版) 题型:填空题
铝土矿的主要成分是Al2O3,还含有Fe2O3、SiO2等杂质。
Ⅰ.从铝土矿中提取氧化铝的流程如下图所示:
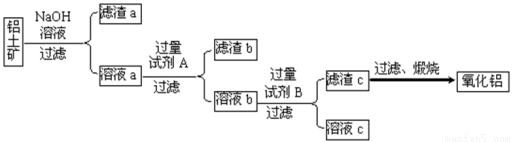
(1)试剂A是 ;
(2)向溶液a中通入过量的CO2,将得到的不溶物煅烧后也可得到Al2O3,该方案的缺点是 。
Ⅱ.电解熔融的氧化铝可制备金属铝
(3)写出电解的化学方程式 。
Ⅲ.新型陶瓷氮化铝可用以下两种方法制备
(4)①氧化铝高温还原法: Al2O3 + C+ N2  AlN+ CO(配平)
AlN+ CO(配平)
②氯化铝与氨气高温合成法:AlCl3+NH3 AlN+3HCl
AlN+3HCl
(5)方法②比方法①在生产上更具优势。下列说法中,正确的是 。
A.方法①中的 Al2O3、C、N2结构稳定,反应时破坏化学键需要消耗更多能量
B.方法①中的Al2O3和C容易残留在氮化铝中
C.两种方法中氮化铝均为还原产物
科目:czhx 来源: 题型:解答题
| 生活垃圾分类 | ||
| 可回收垃圾 | 不可回收垃圾 | 有害垃圾 |
| 1. 纸类 2. 玻璃 3. 金属 4. 塑料 5. 橡胶 6. 纺织品 | 1. 厨房垃圾 2. 灰土 3. 杂草 4. 枯枝 5. 花卉 | 1. 日光灯 2. 电池 3. 喷雾罐 4. 指甲油瓶 5. 药品瓶 6. 涂改液瓶 |
科目:czhx 来源:2007年北京市怀柔区中考化学一模试卷(解析版) 题型:填空题
| 生活垃圾分类 | ||
| 可回收垃圾 | 不可回收垃圾 | 有害垃圾 |
| 1. 纸类 2. 玻璃 3. 金属 4. 塑料 5. 橡胶 6. 纺织品 | 1. 厨房垃圾 2. 灰土 3. 杂草 4. 枯枝 5. 花卉 | 1. 日光灯 2. 电池 3. 喷雾罐 4. 指甲油瓶 5. 药品瓶 6. 涂改液瓶 |
科目:gzhx 来源: 题型:解答题
科目:gzhx 来源: 题型:解答题

科目:gzhx 来源: 题型:解答题

科目:gzhx 来源:绵阳模拟 题型:问答题
科目:gzhx 来源:专项题 题型:填空题
 ___AlN+___CO(请配平);
___AlN+___CO(请配平); AlN+3HCl。
AlN+3HCl。 科目:gzhx 来源:江苏模拟题 题型:填空题

科目:gzhx 来源: 题型:
铝土矿(主要成分为Al2O3、SiO2、Fe2O3)是提取氧化铝的原料。提取氧化铝的工艺流程如下:
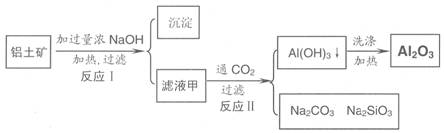
(1)滤液甲的主要成分是
(2)写出反应 II 的离子方程式:
(3)结合反应II,判断下列微粒结合质子 ( H+) 的能力,由强到弱的顺序是 (填字母序号)
a.AlO2 或 Al(OH)4- b.OH C.SiO32
(4)取滤液甲少许,加入过量盐酸,过滤;再用惰性电极电解其滤液,两极均有气体产生,且全部逸出,在阴极区还有沉淀生成,最后沉淀消失。写出阴极的电极反应方程式 ,沉淀消失的原因可用离子方程式表示为:
(5)取(4)电解以后的溶液 10.0 mL,经分析,该溶液中只含有两种等物质的量浓度的碱性溶质,向其中逐滴加入0.100 mol• L-1 盐酸溶液,当加入50.0mL 盐酸溶液时,生成的沉淀恰好溶解。请画出生成沉淀的物质的量与加入盐酸体积的关系图。