
科目:gzhx 来源: 题型:

科目:gzhx 来源: 题型:
| A、将NaF溶液与浓硫酸混合共热制取氟化氢气体 | ||||
B、工业上:H2+Cl2
| ||||
| C、实验室用浓磷酸与溴化钠共热制溴化氢气体 | ||||
| D、实验室用碘化钠与浓硫酸共热制碘化氢气体 |
科目:gzhx 来源: 题型:单选题
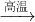 Fe2O3+3H2
Fe2O3+3H2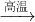 2Fe+Al2O3
2Fe+Al2O3科目:gzhx 来源:2013年北京市丰台区高考化学二模试卷(解析版) 题型:选择题
 Fe2O3+3H2
Fe2O3+3H2 2Fe+Al2O3
2Fe+Al2O3科目:gzhx 来源: 题型:021
下列方法可用于制备卤化氢气体的是
[ ]
A.NaCl与浓硝酸共热制备氯化氢
B.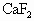 与浓硫酸共热制备氟化氢
与浓硫酸共热制备氟化氢
C.NaBr与浓磷酸共热制备溴化氢
D.NaI与浓硫酸共热制备碘化氢
科目:gzhx 来源:最新名师点评测试卷(高一) 题型:021
下列方法可用于制备卤化氢气体的是
[ ]
A.NaCl与浓硝酸共热制备氯化氢
B.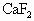 与浓硫酸共热制备氟化氢
与浓硫酸共热制备氟化氢
C.NaBr与浓磷酸共热制备溴化氢
D.NaI与浓硫酸共热制备碘化氢
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:
工业上能用下列方法制备物质的是
A. 用钠在氯气中燃烧制得氯化钠 B. 氢气与氯气充分混合后点燃制得氯化氢
C. 将氯气通入石灰乳中制得漂白粉 D. 将氟气通入氯化钠溶液中制得氯气
科目:gzhx 来源: 题型:单选题
 Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+科目:gzhx 来源:浙江省绍兴市2012届高三上学期期末考试化学试题 题型:013
|
工业上常用电解KHF2与HF的混合物来制备氟气(F2),电解的总反应:2KHF2 | |
| [ ] | |
A. |
电解槽装置的材质宜用石英玻璃制备. |
B. |
阳极的电极反应为:HF2--2e-=F2↑+H+ |
C. |
H+由阴极向阳极移动 |
D. |
液态HF导电性太弱,加入KF后反应生成KHF2,可以增强导电性 |
科目:gzhx 来源: 题型:
工业上可以利用氟硅酸、碳酸氢铵制备冰晶石(Na3AlF6),其工艺如下:
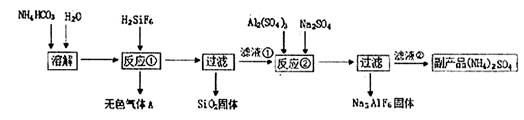
请回答下列问题:
(1)反应①中生成的无色气体A是 ,滤液①的溶质是 。
(2)经测定NH4HCO3溶液呈中性,请分析原因(用离子方程式和文字表述说明理由)
。
(3)经反应②后,过滤得到的冰晶(Na3AlF6)固体,该固体上附着有杂质,需要洗涤,请简述如何证明冰晶石固体已经洗涤干净 。
(4)温度和NH4HCO3浓度会影响反应①的速率。现设计如下实验方案探究温度和NH4HCO3浓度对反应①速率的影响。请在表格空白处填写适当的反应条件。
| 实验编号 | 实验目的 | 温度 | c(NH4HCO3) |
| I | 为以下实验作参照 | 60℃ | c1 |
| II | 探究浓度对反应①速率的影响 | c2 | |
| III | 探究温度对反应①速率的影响 | 80℃ |
(5)下图是滤液①溶质的质量分数随温度变化的曲线图:


请分析t2℃时,滤液①中溶质的质量分数下降的原因是 。
科目:gzhx 来源: 题型:
工业上可以利用氟硅酸、碳酸氢铵制备冰晶石(Na3AlF6),其工艺如下:

请回答下列问题:
(1)反应①中生成的无色气体A是 ,滤液①的溶质是 。
(2)经测定NH4HCO3溶液呈中性,请分析原因(用离子方程式和文字表述说明理由)
。
(3)经反应②后,过滤得到的冰晶(Na3AlF6)固体,该固体上附着有杂质,需要洗涤,请简述如何证明冰晶石固体已经洗涤干净 。
(4)温度和NH4HCO3浓度会影响反应①的速率。现设计如下实验方案探究温度和NH4HCO3浓度对反应①速率的影响。请在表格空白处填写适当的反应条件。
| 实验编号 | 实验目的 | 温度 | c(NH4HCO3) |
| I | 为以下实验作参照 | 60℃ | c1 |
| II | 探究浓度对反应①速率的影响 | c2 | |
| III | 探究温度对反应①速率的影响 | 80℃ |
(5)下图是滤液①溶质的质量分数随温度变化的曲线图:www..co

请分析t1到t2曲线下降的原因是 。
科目:gzhx 来源:2011-2012学年浙江省绍兴市高三(上)期末化学试卷(解析版) 题型:选择题
 F2↑+2KF+H2↑.下列说法正确的是( )
F2↑+2KF+H2↑.下列说法正确的是( )科目:gzhx 来源:2012-2013学年浙江省三县联考高三(上)期中化学试卷(解析版) 题型:选择题
 Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+科目:gzhx 来源: 题型:
Inorganic Syntheses一书中,有一如图所示装置,用以制备某种干燥的纯净气体。该装置中所装的药品正确的是

A、A中装浓硫酸,B中装浓盐酸
B、A中装浓盐酸,B中装浓硫酸
C、A中装氢氧化钠浓溶液,B中装浓氨水
D、A中装浓氟水,B中装氢氧化钠浓溶液
科目:gzhx 来源:不详 题型:单选题
| A.氟气和水反应:2F2+2H2O=4H++4F-+O2 | ||||
B.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O
| ||||
| C.过量氯水与FeI2溶液作用:2Fe2++2I-+2Cl2=2 Fe3++I2+4Cl- | ||||
| D.钠与水反应:Na+2 H2O=Na++OH-+H2↑ |