
科目:czhx 来源: 题型:
| CuO |
| Ca(OH)2 |
| 高温 |
| A、化合、分解、置换、复分解 |
| B、置换、化合、复分解、分解 |
| C、复分解、化合、分解、置换 |
| D、分解、置换、化合、复分解 |
科目:czhx 来源:2013年山东省临沂市中考化学试卷(样卷)(解析版) 题型:填空题

科目:czhx 来源: 题型:解答题
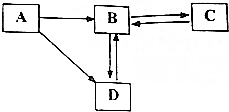 如图是碳和碳的化合物转化关系(箭头表示物质转化过程),已知C为白色固体.
如图是碳和碳的化合物转化关系(箭头表示物质转化过程),已知C为白色固体.科目:czhx 来源: 题型:
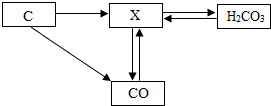 (2013•临沂模拟)如图是碳和碳的化合物间的转化关系,据图回答:
(2013•临沂模拟)如图是碳和碳的化合物间的转化关系,据图回答:
| ||
| ||
科目:gzhx 来源: 题型:阅读理解
| 1 |
| 2 |
| 1 |
| 2 |
| 0min | 5min | 10min | |
| CO | 0.1 | 0.05 | |
| H2 | 0.2 | 0.2 | |
| CH3OH | 0 | 0.04 | 0.05 |
科目:gzhx 来源:2012-2013学年广东省中山市高三上期末统一考试化学试卷(解析版) 题型:计算题
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是理想,更是一种值得期待的新的生活方式,请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应化学方程式为:
____C+____K2Cr2O7 + =___CO2↑+ ____K2SO4 + ____Cr2(SO4)3+ ____H2O
请完成并配平上述化学方程式。
其中氧化剂是________________,氧化产物是_________________
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+ 2H2(g) CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
①已知: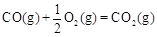 △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1
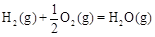 △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO 2和水蒸气时的热化学方程式为 ;
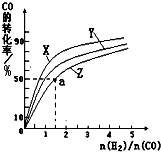
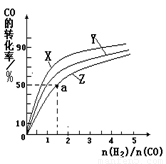
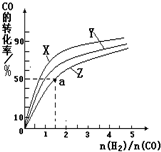
②在容积为1L的恒容容器中,分别研究在230℃、250℃
270℃三种温度下合成甲醇的规律。下图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。
请回答:
ⅰ)在上述三种温度中,曲线Z对应的温度是 。
ⅱ)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+ 2H2(g)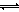 CH3OH(g)的平衡常数K=
。
CH3OH(g)的平衡常数K=
。
③在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol•L-1)变化如下表所示:
|
|
0min |
5min |
10min |
|
CO |
0.1 |
|
0.05 |
|
H2 |
0.2 |
|
0.2 |
|
CH3OH |
0 |
0.04 |
0.05 |
若5min~10min只改变了某一条件,所改变的条件是 ; 且该条件所改变的量是 。
科目:gzhx 来源: 题型:计算题
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是理想,更是一种值得期待的新的生活方式,请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应化学方程式为:
____C+____K2Cr2O7 + =___CO2↑+ ____K2SO4 + ____Cr2(SO4)3+ ____H2O
请完成并配平上述化学方程式。
其中氧化剂是________________,氧化产物是_________________
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+ 2H2(g) CH3OH(g)△H1=-116 kJ·mol-1
CH3OH(g)△H1=-116 kJ·mol-1
①已知: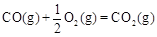 △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1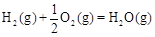 △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO 2和水蒸气时的热化学方程式为 ;
②在容积为1L的恒容容器中,分别研究在230℃、250℃
270℃三种温度下合成甲醇的规律。下图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。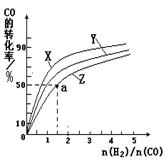
请回答:
ⅰ)在上述三种温度中,曲线Z对应的温度是 。
ⅱ)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+ 2H2(g) CH3OH(g)的平衡常数K= 。
CH3OH(g)的平衡常数K= 。
③在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol•L-1)变化如下表所示:
| | 0min | 5min | 10min |
| CO | 0.1 | | 0.05 |
| H2 | 0.2 | | 0.2 |
| CH3OH | 0 | 0.04 | 0.05 |
科目:gzhx 来源: 题型:解答题
 碳和碳的化合物在人类生产、生活中的应用非常广泛,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.
碳和碳的化合物在人类生产、生活中的应用非常广泛,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.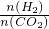 =a,则a的取值范围为______.
=a,则a的取值范围为______.科目:gzhx 来源:枣庄二模 题型:问答题
| n(H2) |
| n(CO2) |
科目:gzhx 来源:2012年山东省枣庄市高考化学二模试卷(解析版) 题型:解答题
 =a,则a的取值范围为______.
=a,则a的取值范围为______.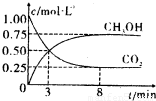
科目:gzhx 来源:不详 题型:计算题
 CH3OH(g)△H1=-116 kJ·mol-1
CH3OH(g)△H1=-116 kJ·mol-1 △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1 △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1
 CH3OH(g)的平衡常数K= 。
CH3OH(g)的平衡常数K= 。 | | 0min | 5min | 10min |
| CO | 0.1 | | 0.05 |
| H2 | 0.2 | | 0.2 |
| CH3OH | 0 | 0.04 | 0.05 |
科目:czhx 来源:2017届山东省九年级3月一轮复习阶段测化学试卷(解析版) 题型:选择填充题
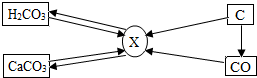
碳和碳的化合物间的部分转化关系如图所示.则下列说法正确的是( )
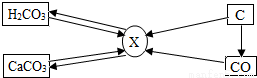
A. 由碳酸转化成X一定要在加热条件下进行
B. 由碳转化为X一定发生的是化合反应
C. 物质X一定是二氧化碳
D. 若使一氧化碳转化成X,只能通过一氧化碳在空气(或氧气)中燃烧获得
科目:gzhx 来源: 题型:
 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是理想,更是一种值得期待的新的生活方式,请运用化学反应原理的相关知识研究碳及其化合物的性质.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是理想,更是一种值得期待的新的生活方式,请运用化学反应原理的相关知识研究碳及其化合物的性质.| 1 |
| 2 |
| 1 |
| 2 |
| 0min | 5min | 10min | |
| CO | 0.1 | 0.05 | |
| H2 | 0.2 | 0.2 | |
| CH3OH | 0 | 0.04 | 0.05 |
科目:czhx 来源: 题型:解答题
 ,碳原子的核电荷数为6.
,碳原子的核电荷数为6.
科目:czhx 来源: 题型:选择题
 碳和碳的化合物间的部分转化关系如图所示.则下列说法正确的是( )
碳和碳的化合物间的部分转化关系如图所示.则下列说法正确的是( )| A. | 由碳酸转化成X一定要在加热条件下进行 | |
| B. | 由碳转化为X一定发生的是化合反应 | |
| C. | 物质X一定是二氧化碳 | |
| D. | 若使一氧化碳转化成X,只能通过一氧化碳在空气(或氧气)中燃烧获得 |
科目:gzhx 来源:2012-2013学年山东省文登市高三3月模拟考试化学试卷(解析版) 题型:填空题
近年来,碳和碳的化合物在生产生活实际中应用广泛。
(1)在2升的密闭容器中,充有2mol CO与4mol 水蒸气,在催化剂作用下进行如下化学反应:CO(g)+H2O(g)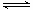 CO2(g)+H2(g),CO的转化率和温度t的关系如下表:
CO2(g)+H2(g),CO的转化率和温度t的关系如下表:
|
t(℃) |
750 |
850 |
1000 |
|
CO% |
0.7 |
2/3 |
0.5 |
1000℃时该反应的平衡常数为___________________。850℃时,向该容器中重新通入1mol CO、1.5mol H2O、0.5mol CO2和2molH2,此时反应___________(填“向右进行”、“向左进行”或“处于平衡状态”)。
(2)已知:C(s)+O2 (g) ===CO2(g) △H1=﹣393.5kJ·mol-1
2H2(g)+O2(g)=== 2H2O(g) △H2=﹣483.6kJ·mol-1
C(s)+H2O(g)=== CO(g)+H2(g) △H3=+131.3kJ·mol-1
则CO和H2O生成CO2和H2的热化学方程式为_______________________________。
(3) 目前工业上可用CO2来生产燃料甲醇,有关反应为:
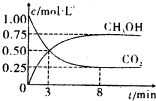
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。现向体积为1 L的密闭容器中,充入
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。现向体积为1 L的密闭容器中,充入
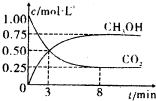
1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。

①从反应开始到平衡,氢气的平均反应速率v(H2)=_____________;
②若改变条件使平衡向正反应方向移动,则平衡常数______________(填序号)
a.可能不变 b.可能减小 c.可能增大 d.不变、减小、增大皆有可能
(4)NaHCO3的水溶液呈碱性,其原因是(用文字叙述)_______________________。常温下,向100mL
0.2mol/LNaHCO3溶液中滴加amol/L的醋酸溶液,当滴加到溶液呈中性时,所用去的醋酸体积刚好也
为100mL,此时醋酸的电离常数为b, 用含b的代数式表示醋酸的浓度a=_____________________。
科目:gzhx 来源: 题型:填空题
(16分)碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是理想,更是一种值得期待的新的生活方式,请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应化学方程式为:
____C+____K2Cr2O7 + ====___CO2↑+ ____K2SO4 + ____Cr2(SO4)3+ ____H2O
请完成并配平上述化学方程式。
其中氧化剂是________________,氧化产物是_________________
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+ 2H2(g) CH3OH(g)△H1=-116 kJ·mol-1
CH3OH(g)△H1=-116 kJ·mol-1
①已知: △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1 △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO 2和水蒸气时的热化学方程为 ;
②在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律。下图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。请回答: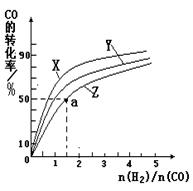
ⅰ)在上述三种温度中,曲线Z对应的温度是
ⅱ)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+ 2H2(g) CH3OH(g)的平衡常数K= 。
CH3OH(g)的平衡常数K= 。
③在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol•L-1)变化如下表所示:
| | 0min | 5min | 10min |
| CO | 0.1 | | 0.05 |
| H2 | 0.2 | | 0.2 |
| CH3OH | 0 | 0.04 | 0.05 |
科目:gzhx 来源: 题型:填空题
近年来,碳和碳的化合物在生产生活实际中应用广泛。
(1)在2升的密闭容器中,充有2mol CO与4mol 水蒸气,在催化剂作用下进行如下化学反应:CO(g)+H2O(g) CO2(g)+H2(g),CO的转化率和温度t的关系如下表:
CO2(g)+H2(g),CO的转化率和温度t的关系如下表:
| t(℃) | 750 | 850 | 1000 |
| CO% | 0.7 | 2/3 | 0.5 |
 CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。现向体积为1 L的密闭容器中,充入
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。现向体积为1 L的密闭容器中,充入
科目:gzhx 来源:不详 题型:填空题
 CO2(g)+H2(g),CO的转化率和温度t的关系如下表:
CO2(g)+H2(g),CO的转化率和温度t的关系如下表:| t(℃) | 750 | 850 | 1000 |
| CO% | 0.7 | 2/3 | 0.5 |
 CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。现向体积为1 L的密闭容器中,充入
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。现向体积为1 L的密闭容器中,充入
科目:gzhx 来源:不详 题型:填空题
 CH3OH(g)△H1=-116 kJ·mol-1
CH3OH(g)△H1=-116 kJ·mol-1 △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1 △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1
 CH3OH(g)的平衡常数K= 。
CH3OH(g)的平衡常数K= 。 | | 0min | 5min | 10min |
| CO | 0.1 | | 0.05 |
| H2 | 0.2 | | 0.2 |
| CH3OH | 0 | 0.04 | 0.05 |