10.
C、N、O、Na、Al、Si、S、Cl是常见的八种元素
请回答下列问题:
(1)Si在元素周期表中的位置为第三周期第IVA族;CO
2的电子式是

.
(2)上述元素中原子半径最大的是(写元素符号)Na;最高价氧化物对应的水化物酸性最强的是HClO
4(写化学式).
(3)下列事实能说明O元素的非金属性比S元素的非金属性强的是ab.
a.O
2与H
2S溶液反应,溶液变浑浊
b.O和S两元素的简单氢化物受热分解,前者的分解温度高
c.在氧化还原反应中,1molO
2比1molS得电子多
(4)金刚石具有优良的耐磨,耐腐蚀性,应用广泛.一定条件下,Na还原CCl
4可制备金刚石.反应结束冷却至室温后,回收其中的CCl
4的实验操作名称为过滤,除去粗产品中少里钠的试剂为水(或乙醇).
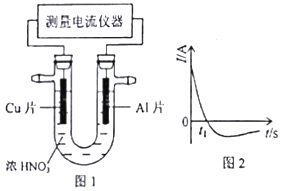
(5)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO
3中组成原电池(图l),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生.0~t
1时,原电池的负极是Al片,此时,正极的电极反应式是2H
++NO
3-+e
-=NO
2↑+H
2O,溶液中的H
+向正极移动.t
1时,原电池中电子流动方向发生改变,其原因是:随着反应进行铝表面钝化形成氧化膜阻碍反应进行,铜做负极反应,电流方向相反.

 C、N、O、Na、Al、Si、S、Cl是常见的八种元素
C、N、O、Na、Al、Si、S、Cl是常见的八种元素 .
.