利用co2和ch4重整可制合成气.已知重整过程中部分反应的热化学方程式为答案解析
科目:gzhx
来源:
题型:填空题
8.利用CO2和CH4重整可制合成气(主要成分为CO、H2),已知重整过程中部分反应的热化学方程式为:
①CH4(g)═C(s)+2H2(g)△H=+75.0KJ•mol-1
②CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41.0KJ•mol-1
③CO(g)+H2(g)═C(s)+H2O(g)△H=-131.0KJ•mol-1
反应CO2(g)+CH4(g)═2CO(g)+2H2(g)的△H=247KJ•mol-1.
查看答案和解析>>
科目:gzhx
来源:
题型:解答题
19.Ⅰ.利用CO
2和CH
4重整可制合成气(主要成分为CO、H
2),已知重整过程中部分反应的热化学方程式为:
①CH
4(g)=C(s)+2H
2(g)△H=+75.0kJ•mol
-1②CO
2(g)+H
2(g)=CO(g)+H
2O(g)△H=+41.0kJ•mol
-1③CO(g)+H
2(g)=C(s)+H
2O(g)△H=-131.0kJ•mol
-1反应CO
2(g)+CH
4(g)=2CO(g)+2H
2(g)的△H=+247kJ•mol
-1.
II.用CO合成尿素的反应为:2NH
3(g)+CO(g)⇌CO(NH
2)
2(g)+H
2(g)△H<0.
(1)T℃时,向体积为2L的恒容密闭容器中,充入2molNH
3和1mol CO发生反应.
①5min时反应达到平衡状态,CO的转化率为80%,则5min内NH
3的平均反应速率为0.16mol·L
-1·min
-1,此温度下反应的平衡常数K的值为40.
②对该反应,下列说法正确的是CD(填字母).
A.若容器内气体密度不变,则表明反应达到平衡状态
B.反应达到平衡后,其它条件不变,升高温度,尿素的百分含量增大
C.反应达到平衡后,其它条件不变,在原容器中充入一定量氦气,CO的转化率不变
D.反应达到平衡后,其它条件不变,充入一定量NH
3,平衡向正反应方向移动,但K值不变
(2)若保持恒温恒容条件,将物质的量之和为3mol的NH
3和CO以不同的氨碳比进行反应,结果如图1所示:若图中c表示平衡体系中尿素的体积分数,则b表示NH
3的转化率.当尿素含量最大时,则$\frac{n(N{H}_{3})}{n(CO)}$=2或2:1,此时,对于该反应既能增大反应速率又能提高尿素体积分数的措施为按物质的量之比为2:1再加入NH
3和CO增大压强.

Ⅲ.图2是铬酸银(Ag
2CrO
4)T℃时,在水溶液中的沉淀溶解平衡曲线.
(1)向饱和Ag
2CrO
4溶液中加入固体K
2CrO
4不能(填“能”或“不能”)使溶液由Y点变为X点
(2)图中ɑ=$\sqrt{2}$×10
-4(或1.4×10
-4).
查看答案和解析>>
科目:czhx
来源:
题型:实验探究题
13.小明同学在复习过实验室气体的制备后,选择了如下练习题,请你和他共同完成:
㈠如图,在实验台上放置两瓶气体,集气瓶A、B中各分别盛有CO
2、O
2、H
2中的一种;

(1)由放置方法判断出A瓶中的气体是H
2,实验室制备该气体的化学方程式为:Zn+H
2SO
4=ZnSO
4+H
2↑;
(2)将带火星的木条伸入B瓶中,若木条复燃,则B瓶中的气体是O
2;
㈡(1)已知甲烷难溶于水、密度比空气小;实验室常用无水醋酸钠和碱石灰两种固体加热获得甲烷气体,则制取和收集甲烷的装置组合是AC或AD(选填上图中的序号);将反应物装入试管前,应先检查装置的气密性,简述用排水法收集一瓶甲烷气体的完整操作方法当气泡连续均匀地放出时,把导管伸入盛满水的集气瓶中,甲烷充满集气瓶后,将导管从瓶口移开,在水下用玻璃片盖住瓶口,把集气瓶移出水槽,倒放在桌上;
(2)点燃甲烷前一定要先验纯,甲烷也是一种很重要的化工原料,在催化剂的作用下,可以将CO
x和CH
4的混合气体直接转化为醋酸(CH
3COOH),若该反应的原子利用率为100%(反应物中的原子全部转化为目标产物中的原子),则CO
x中的x为2,该反应类型是化合反应.
查看答案和解析>>
科目:gzhx
来源:
题型:解答题
10.
数十年来,化学工作者对碳的氧化物和氢化物做了广泛深入的研究并取得了一些
重要成果.
已知:C(s)+O
2(g)═CO
2(g);△H=-393kJ•mol
-12CO (g)+O
2(g)═2CO
2(g);△H=-566kJ•mol
-12H
2(g)+O
2(g)═2H
2O(g);△H=-484kJ•mol
-1(1)工业上常采用将水蒸气喷到灼热的炭层上实现煤的气化(制得CO、H
2),该反应的热化学方程式是C(s)+H
2O(g)=CO(g)+H
2(g);△H=+132kJ•mol
-1.
(2)上述煤气化过程中需向炭层交替喷入空气和水蒸气,喷入空气的目的是让部分炭燃烧,提供炭与水蒸气反应所需要的热量;该气化气可在加热和催化剂下合成液体燃料甲醇,该反应方程式为CO+2H
2$\frac{\underline{催化剂}}{△}$CH
3OH.
(3)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到.
第一步:2CH
3OH(g)═HCOOCH
3(g)+2H
2(g)△H>0
第二步:HCOOCH
3(g)═CH
3OH(g)+CO(g)△H>0
则以甲醇制一氧化碳的反应为吸热反应(填“吸热”、“放热”).
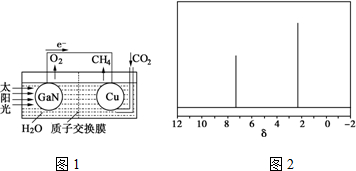
(4)科学家用氮化镓材料与铜组装如图1的人工光合系统,利用该装置成功地实现了以CO
2和H
2O合成CH
4.
①写出铜电极表面的电极反应式CO
2+8e
-+8H
+=CH
4+2H
2O.
②为提高该人工光合系统的工作效率,可向装置中加入少量硫酸(选填“氢氧化钠”或“硫酸”).
(5)天然气也可重整生产化工原料,最近科学家们利用天然气无氧催化重整获得芳香烃X.
由质谱分析得X的相对分子质量为106,其核磁共振氢谱如图2,则X的结构简式为
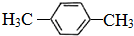
.
查看答案和解析>>
科目:gzhx
来源:
题型:实验题
19.数十年来,化学工作者对碳的氧化物做了广泛深入的研究并取得了一些重要成果.如利用CO
2和CH
4重整可制合成气(主要成分为CO、H
2),已知重整过程中部分反应的热化学方程式为:
I、CH
4(g)═C(s)+2H
2(g)△H=+75.0kJ•mol
-1II、CO
2(g)+H
2(g)═CO(g)+H
2O(g)△H=+41.0kJ•mol
-1III、CO(g)+H
2(g)═C(s)+H
2O(g)△H=-131.0kJ•mol
-1(1)反应CO
2(g)+CH
4(g)═2CO(g)+2H
2(g)的△H=+247kJ•mol
-1.
(2)固定n(CO
2)=n(CH
4),改变反应温度,CO
2和CH
4的平衡转化率见图甲.
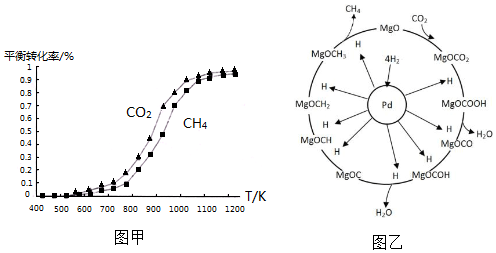
①同温度下CO
2的平衡转化率大于(填“大于”或“小于”)CH
4的平衡转化率,其原因是CO
2发生了其他副反应.
②高温下进行该反应时常会因反应I生成“积碳”(碳单质),造成催化剂中毒,高温下反应I能自发进行的原因是△S>0.
(3)一定条件下Pd-Mg/SiO
2催化剂可使CO
2“甲烷化”从而变废为宝,其反应机理如图乙所示,该反应的化学方程式为CO
2+4H
2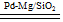
CH
4+2H
2O.
(4)CO常用于工业冶炼金属,如图是在不同温度下CO还原四种金属氧化物达平衡后气体中lg[c(CO)/c(CO
2)]与温度(t)的关系曲线图.下列说法正确的是BC.
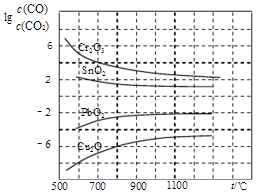
A.工业上可以通过增高反应装置来延长矿石和
CO接触的时间,减少尾气中CO的含量
B.CO不适宜用于工业冶炼金属铬(Cr)
C.工业冶炼金属铜(Cu)时较低的温度有利于
提高CO的利用率
D.CO还原PbO
2的反应△H>0
(5)在载人航天器中应用电化学原理,以Pt为阳极,Pb(CO
2的载体)为阴极,KHCO
3溶液为电解质溶液,还原消除航天器内CO
2同时产生O
2和新的能源CO,总反应的化学方程式为:2CO
2$\frac{\underline{\;通电\;}}{\;}$2CO+O
2,则其阳极的电极反应式为4OH
--4e
-=O
2↑+2H
2O.
查看答案和解析>>



 数十年来,化学工作者对碳的氧化物和氢化物做了广泛深入的研究并取得了一些
数十年来,化学工作者对碳的氧化物和氢化物做了广泛深入的研究并取得了一些 .
.  ①同温度下CO2的平衡转化率大于(填“大于”或“小于”)CH4的平衡转化率,其原因是CO2发生了其他副反应.
①同温度下CO2的平衡转化率大于(填“大于”或“小于”)CH4的平衡转化率,其原因是CO2发生了其他副反应.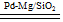 CH4+2H2O.
CH4+2H2O.