
科目:gzhx 来源: 题型:
 (1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应.如:6Ag(s)+O3(g)=3Ag2O(s)△H1
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应.如:6Ag(s)+O3(g)=3Ag2O(s)△H1| 催化剂 |
| 投料比[n(NO2)/n(CH4)] | 400K | 500K | 600K |
| 1 | 60% | 43% | 28% |
| 2 | 45% | 33% | 20% |
科目:gzhx 来源:2014-2015广东省湛江市高二第一学期期末化学试卷(解析版) 题型:填空题
(13分) (1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s) + O3(g) = 3Ag2O(s) ΔH1
已知2Ag2O(s) = 4Ag(s) + O2(g) ΔH2
则常温下反应: 2O3(g) = 3O2(g)的ΔH= (用ΔH1和ΔH2表示).
(2)在恒压下,将CH4(g)和NO2(g)置于密闭容器中发生化学反应:
CH4(g) +2NO2(g) N2(g) +CO2(g) +2H2O(g)
N2(g) +CO2(g) +2H2O(g)
在不同温度、不同投料比时,NO2的平衡转化率见下表:
投料比[n(NO2) / n(CH4)] | 400 K | 500 K | 600 K |
1 | 60% | 43% | 28% |
2 | 45% | 33% | 20% |
①写出该反应平衡常数的表达式K = 。
②若温度不变,提高[n(NO2) / n(CH4)]投料比,则NO2的平衡转化率 。(填“增大”、“减小”或“不变”。)
③由上表可知该可逆反应的正反应是 反应。
④400 K时,将投料比为1的NO2和CH4的混合气体共0.04 mol,充入一装有催化剂的容器中,充分反应后,平衡时NO2的体积分数 。
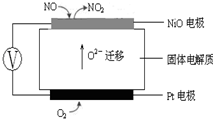
(3)下图为连续自动监测氮氧化物(NOx)的仪器动态库仑仪的工作原理示意图。则NiO电极上NO发生的电极反应式为: 。
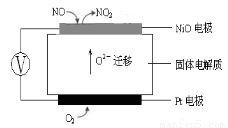
科目:gzhx 来源: 题型:解答题
科目:gzhx 来源: 题型:解答题
 CH4(g)+H2O(g)△H=-203kJ•mol-1.
CH4(g)+H2O(g)△H=-203kJ•mol-1.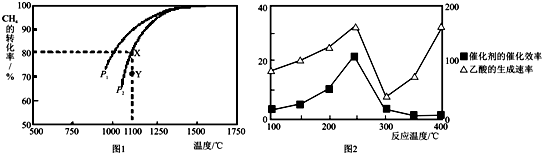
科目:gzhx 来源: 题型:解答题

科目:gzhx 来源: 题型:解答题

科目:gzhx 来源: 题型:解答题

科目:gzhx 来源: 题型:解答题
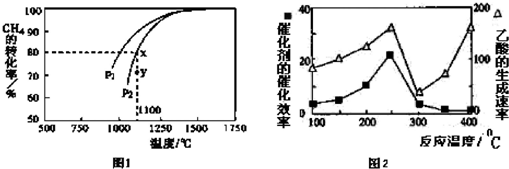
科目:gzhx 来源: 题型:解答题
 能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.
能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.科目:gzhx 来源: 题型:解答题
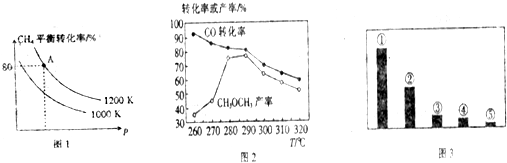
科目:gzhx 来源: 题型:

科目:gzhx 来源:2014-2015学年广东省惠州市高三第三次调研考试化学试卷(解析版) 题型:填空题
(16分)实现反应CH4(g)+CO2(g) 2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义。
2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义。
(1)已知:① 2CO(g)+O2(g)=2CO2(g) △H1=-566 kJ·mol-1
② 2H2(g)+O2(g)=2H2O(g) △H2=-484 kJ·mol-1
③ CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H3=-802 kJ·mol-1
则△H0= kJ·mol-1
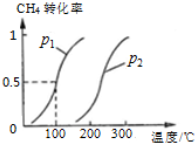
(2)在密闭容器中,通入2.5mol的CH4与2.5mol CO2,一定条件下发生反应:CH4(g)+CO2(g) 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图。
2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图。
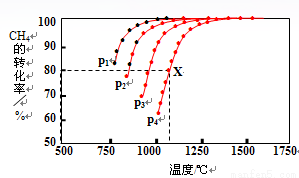
据图可知,p1、p2、 p3、p4由大到小的顺序 。
(3)CO和H2还可以通过反应C(s)+H2O(g) CO(g)+H2 (g) 制取。
CO(g)+H2 (g) 制取。
① 在恒温恒容下,若从反应物出发建立平衡,已达到平衡的是
A.体系压强不再变化 B.CO与H2的物质的量之比为1:1
C.混合气体的密度保持不变 D.每消耗1mol H2O(g)的同时生成1mol H2
② 恒温下,在2L的密闭容器中同时投入四种物质,10min时达到平衡,测得容器中有1mol H2O(g)、1mol CO(g)、2molH2(g)和2molC(s),反应的平衡常数K= 。
若此时增大压强,平衡将向 (填“正”、“逆”)反应方向移动,t1min时达到新的平衡。
③ 请画出增大压强后10min~t1min时容器中H2物质的量n随时间变化的曲线图。

科目:gzhx 来源: 题型:填空题
科目:gzhx 来源: 题型:解答题

科目:gzhx 来源: 题型:解答题
 丙烯(C3H6)是制造聚丙烯、丙烯腈等化工产品的原料.目前正在开发丙烷(C3H8)裂解制取丙烯,其原理为C3H8(g)⇌C3H6(g)+H2(g)△H.回答下列问题:
丙烯(C3H6)是制造聚丙烯、丙烯腈等化工产品的原料.目前正在开发丙烷(C3H8)裂解制取丙烯,其原理为C3H8(g)⇌C3H6(g)+H2(g)△H.回答下列问题:| 共价键 | C-C | C=C | C-H | H-H |
| 键能/KJ•mol-1 | 348 | 615 | 413 | 436 |
| n(CO2)/n(C3H8)温度/K | 600 | 700 | 800 | 900 | 1000 |
| 0:1 | 1.0% | 6.3% | 24.4% | 59.6% | 87.0% |
| 1:1 | 2.7% | 12.9% | 41.6% | 78.0% | 94.5% |
| 1:2 | 3.7% | 17.2% | 50.9% | 85.3% | 97.1% |
| 1:3 | 4.0% | 20.5% | 57.7% | 89.5% | 98.2% |
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:

科目:gzhx 来源: 题型:
 碳、氮、硫、氯是四种重要的非金属元素.
碳、氮、硫、氯是四种重要的非金属元素.| HClO | HSCN | H2CO3 |
| K=3.2×10-8 | K=0.13 | Kl=4.2×10-7 K2=5.6×10-11 |
科目:gzhx 来源:2013-2014学年山东省济南市高三3月模拟考试理综化学试卷(解析版) 题型:填空题
(16分)碳、氮、硫、氯是四种重要的非金属元素。
(1)CH4(g)在O2(g)中燃烧生成CO(g)和H2O(g)的△H难以直接测量,原因是 。
已知:a.2CO(g)+O2(g)=2CO2(g) △H =-566.0 kJ·mol-1
b.CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H =-890.0 kJ·mol-1
则CH4(g)在O2(g)中燃烧生成CO(g)和H2O(g)的热化学方程式为 。
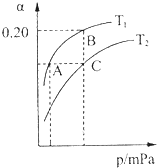
(2)工业上合成氨气的反应为:N2(g)+3H2(g) 2NH3(g) △H<0。现将10 mol N2和26 mol H2置于容积可变的密闭容器中,N2的平衡转化率(
2NH3(g) △H<0。现将10 mol N2和26 mol H2置于容积可变的密闭容器中,N2的平衡转化率(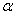 )与体系总压强(P)、温度(T)的关系如图所示。回答下列问题:
)与体系总压强(P)、温度(T)的关系如图所示。回答下列问题:
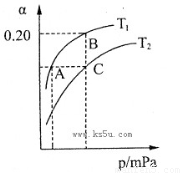
①反应达到平衡状态B时,容器的容积10 L,则T1时,合成氨反应的平衡常数K= L2·mol-1。
②平衡状态由A变到C时,对应的平衡常数K(A) K(C)(填“>”、“<”或“=”)。
(3)在25℃时,HSCN、HClO、H2CO3的电离常数如下表:
HClO | HSCN | H2CO3 |
K=3.210-8 | K=0.13 | Kl=4.210-7 K2=5.610-11 |
①1 mol·L-1的KSCN溶液中,所有离子的浓度由大到小的顺序为 > > > 。
②向Na2CO3溶液中加入过量HClO溶液,反应的化学方程式为 。
③25℃时,为证明HClO为弱酸,某学习小组的同学没计了以下三种实验方案。下列三种方案中,你认为能够达到实验目的的是 (填下列各项中序号)。
a.用pH计测量0.1 mol·L-1NaClO溶液的pH,若测得pH>7,可证明HClO为弱酸
b.用pH试纸测量0.01 mol·L-1HClO溶液的pH,若测得pH>2,可证明HClO为弱酸
c、用仪器测量浓度均为0.1 mol·L-1的HClO溶液和盐酸的导电性,若测得HClO溶液的导电性弱于盐酸,可证明HClO为弱酸
科目:gzhx 来源: 题型:填空题
(16分)碳、氮、硫、氯是四种重要的非金属元素。
(1)CH4(g)在O2(g)中燃烧生成CO(g)和H2O(g)的△H难以直接测量,原因是 。
已知:a.2CO(g)+O2(g)=2CO2(g) △H =-566.0 kJ·mol-1
b.CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H =-890.0 kJ·mol-1
则CH4(g)在O2(g)中燃烧生成CO(g)和H2O(g)的热化学方程式为 。
(2)工业上合成氨气的反应为:N2(g)+3H2(g)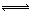 2NH3(g) △H<0。现将10 mol N2和26 mol H2置于容积可变的密闭容器中,N2的平衡转化率(
2NH3(g) △H<0。现将10 mol N2和26 mol H2置于容积可变的密闭容器中,N2的平衡转化率(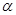 )与体系总压强(P)、温度(T)的关系如图所示。回答下列问题:
)与体系总压强(P)、温度(T)的关系如图所示。回答下列问题: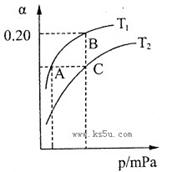
①反应达到平衡状态B时,容器的容积10 L,则T1时,合成氨反应的平衡常数K= L2·mol-1。
②平衡状态由A变到C时,对应的平衡常数K(A) K(C)(填“>”、“<”或“=”)。
(3)在25℃时,HSCN、HClO、H2CO3的电离常数如下表:
| HClO | HSCN | H2CO3 |
| K=3.210-8 | K=0.13 | Kl=4.210-7 K2=5.610-11 |