精英家教网 >
试题搜索列表 >以含有ca2+.mg2+.cl.so42ˉ.brˉ等离子的卤水为主要原料可制备金属镁和溴.流程如下
以含有ca2+.mg2+.cl.so42ˉ.brˉ等离子的卤水为主要原料可制备金属镁和溴.流程如下答案解析
科目:gzhx
来源:
题型:解答题
7.以含有Ca
2+、Mg
2+、Cl
-、SO
42-、Br
-等离子的卤水为主要原料可制备金属镁和溴.流程如下:
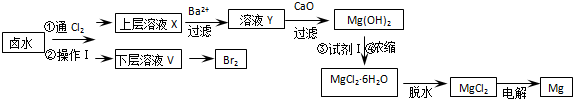
(1)操作Ⅰ的名称是萃取分液,所用主要玻璃仪器的名称是分液漏斗、烧杯.
(2)加入Ba
2+的目的是除去溶液中的SO
42-.用CaO调节溶液Y的pH,可以使Mg
2+沉淀完全.由下表中数据可知,理论上选择pH范围是11.0<PH<12.2.
| 开始沉淀时 | 沉淀完全时 |
| Mg2+ | pH=9.6 | pH=11.0 |
| Ca2+ | pH=12.2 | c(OH-)=1.8mol/L |
(3)在空气中加热MgCl
2•6H
2O,可以生成Mg(OH)Cl,相应反应的化学方程式是MgCl
2•6H
2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)Cl+HCl↑+5H
2O↑.
(4)化肥厂生产铵态氮肥(NH
4)
2SO
4的部分流程如图:

向装有CaSO
4悬浊液的沉淀池中先通氨气,再通CO
2的原因(请从溶解度和平衡移动角度分析)NH
3极易溶于水且溶于水后电离出氢氧根离子,溶液显碱性,增加了二氧化碳的溶解性,生成了更多的CO
32-,CO
32-离子交换Ca
2+形成更难溶的CaCO3,使CaSO4(s)⇌Ca
2+(aq)+SO
42-(aq)溶解平衡向右移动,提高(NH
4)
2SO
4的产量.
查看答案和解析>>
科目:gzhx
来源:
题型:实验题
1.以含有Ca
2+、Mg
2+、Cl
-、SO
42-、Br
-等离子的卤水为主要原料可制备金属镁和溴.流程如图1:
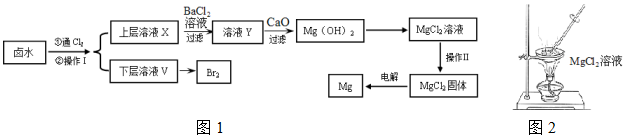
(1)操作Ⅰ的名称是萃取分液,所用主要玻璃仪器的名称是分液漏斗、烧杯;需要选择的试剂是c(填序号).
a.乙醇 b.苯 c.四氯化碳 d.裂化汽油
(2)通氯气反应的离子方程式Cl
2+2Br
-=2Cl
-+Br
2.
(3)证明SO
42-完全沉淀的方法是静置向上层清液中继续加入BaCl
2溶液,若不产生白色沉淀则证明SO
42-已沉淀完全.
(4)CaO用来调节溶液Y的pH,可以使Mg
2+沉淀完全,由表中数据可知,理论上应控制pH范围是11.0<pH<12.2.
| 开始沉淀时 | 沉淀完全时 |
| Mg2+ | pH=9.6 | pH=11.0 |
| Ca2+ | pH=12.2 | c(OH-)=1.8mol/L |
(5)操作Ⅱ用图2所示操作不能实现(填“能”或“不能”).原因是MgCl
2+2H
2O⇌Mg(OH)
2+2HCl(用化学方程式解释).
(6)工业上用惰性电极电解熔融状态下的氯化镁来冶炼镁,不能直接电解氯化镁溶液的原因是Mg
2++2H
2O+2Cl
-$\frac{\underline{\;通电\;}}{\;}$Mg(OH)
2↓+H
2↑+Cl
2↑(用离子方程式表示).
(7)在探究Mg(OH)
2溶解性的实验中,发现向装有少量Mg(OH)
2浊液的试管中加入适量NH
4Cl晶体,充分振荡后浊液会变澄清,请用化学平衡的原理解释浊液变澄清的原因Mg(OH)
2(s)⇌Mg
2+(aq)+2OH
-(aq),NH
4Cl电离出的NH
4+与OH
‑结合成弱电解质一水合氨,降低了c(OH
-),Mg(OH)
2溶解平衡向右移动.
查看答案和解析>>



