h.c.n.o.na.al.s.cl.ca是常见的9种元素答案解析
科目:gzhx
来源:
题型:解答题
16.H、C、N、O、Na、Al、S、Cl、Ca是常见的9种元素.
(1)写出由上述9种元素的几种组成的既含有离子键又含共价键的离子化合物的化学式NaOH(或NaClO、Na
2O
2等);既含极性共价键又含非极性共价键的共价化合物的化学式H
2O
2(或C
2H
4、N
2H
4).
(2)O元素的一种中子数为10的核素的符号表示为
818O,N的原子结构示意图
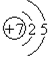
.
(3)上述9种元素中的金属工业冶炼方法是A
A.全部采用电解法
B.其中2种采用电解法,另外一种采用热分解法
C.其中一种采用电解法,另外两种采用热还原法
D.全部采用加热分解法
(4)用“大于”“小于”或“等于”填空
| 离子半径 | 还原性 | 得电子能力 |
| N3-大于Al3+ | O2-小于S2- | 35Cl等于37Cl |
(5)甲与乙在溶液中的转化关系如右图所示(反应条件省略)甲不可能是D.

A.NH
3 B.AlO
2- C.CO
32- D.CH
3COO
-(6)CaCO
3和适量HCl溶液反应,当反应至无气泡逸出后,取适量残留溶液,插入pH传感器并逐滴滴入碳酸钠溶液,测得PH变化曲线如图所示.
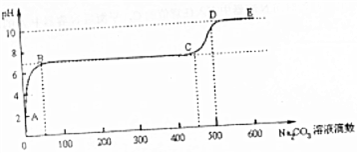
请用离子方程式表示B-C段发生的反应Ca
2++CO
32-=CaCO
3↓;C点到D点pH增大的原因可用离子方程式表示为CO
32-+H
2O⇌HCO
3-+OH
-.
查看答案和解析>>
科目:gzhx
来源:
题型:解答题
9.H、N、O、Si、Cl、Na、Al、Fe、F、S都是中学化学常见的元素.请根据题意回答与这些元素有关的问题.
(1)Al在周期表中的位置第三周期ⅢA族.Na的原子结构示意图为

,Na在氧气中完全燃烧所得产物的电子式为

(2)以上某种元素的氢化物和该元素的最高价含氧酸反应可以生成盐.请写出实验室制备该元素氢化物的方程式Ca(OH)
2+2NH
4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl
2+2NH
3↑+2H
2O.
(3)以上的主族元素中,原子半径最小的是H,非金属性最强的是F,单质能用于芯片制造的是Si (均填元素符号).
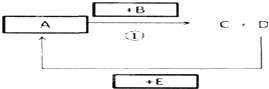
(4)已知由以上元素组成的单质或化合物A、B、C、D能发生如图的转化(部分产物和条件已省略),其中反应①为置换反应,回答下列问题:
①若A由两种元素组成,常温下呈液态,组成单质B的元素是短周期中原子半径最大的,则反应①的方程式为2Na+2H
2O=2NaOH+H
2↑.
②若B是地壳中含量最高的金属元素的单质,E为水,D与E的反应在高温下进行,则A的化学式是Fe
3O
4.
③若B是一种正盐,其焰色反应呈黄色,向B的溶液中通入黄绿色气体A,出现黄色沉淀,则反应①的离子方程式为S
2-+Cl
2=S↓+2Cl
-.
查看答案和解析>>

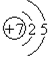 .
.

 ,Na在氧气中完全燃烧所得产物的电子式为
,Na在氧气中完全燃烧所得产物的电子式为
