
科目:gzhx 来源: 题型:解答题
科目:gzhx 来源: 题型:
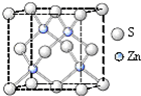 Ga和As在一定条件下可以合成GaAs,GaAs是一种新型化合物半导体材料,其性能比硅更优越.多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、硫化锌及铜锢硒薄膜电池等.
Ga和As在一定条件下可以合成GaAs,GaAs是一种新型化合物半导体材料,其性能比硅更优越.多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、硫化锌及铜锢硒薄膜电池等.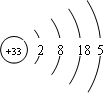

科目:gzhx 来源: 题型:解答题
科目:gzhx 来源: 题型:实验题
科目:gzhx 来源:高考三人行 化学 题型:013
在周期表中相邻元素的性质相似,镓(Ga)在周期表中位于第四周期ⅢA族,下列关于镓的一些说法错误的是
[ ]
A.镓的最高价氧化物的水化物既能与强酸反应又能与强碱反应
B.氯化镓溶液呈酸性
C.镓的单质不能与乙醇反应
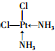
D.镓可形成![]()
科目:gzhx 来源: 题型:解答题
科目:gzhx 来源: 题型:解答题

| Al(OH)3 | Ga(OH)3 | |
| 酸式电离常数Ka | 2×10-11 | 1×10-2 |
| 碱式电离常数Kb | 1.3×10-33 | 1.4×10-34 |
科目:gzhx 来源: 题型:解答题
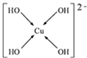 ;N3-和CO2是等电子体,则N3-的结构式为[N=N=N]-.
;N3-和CO2是等电子体,则N3-的结构式为[N=N=N]-.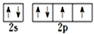 .
.科目:gzhx 来源:2014届东北三省四市教研协作体高三联合考试理综化学试卷(解析版) 题型:填空题
太阳能电池的发展已经进入了第三代。第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜铟镓硒CIGs(CIS中掺入Ga)等化合物薄膜太阳能电池以及薄膜Si系太阳能电池。
(1)亚铜离子(Cu+)基态时的价电子排布式表示为 。
(2)硒为第4周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为 (用元素符号表示)。
(3)Cu晶体的堆积方式是 (填堆积名称),其配位数为 ;往Cu的硫酸盐溶液中加入过量氨水,可生成[Cu(NH3)4]SO4,下列说法正确的是_____
A.[Cu (NH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Cu(NH3)4 ]2+中Cu2+给出孤对电子,NH3提供空轨道
C.[Cu (NH3)4]SO4组成元素中第一电离能最大的是氧元素
D.SO42-与PO43-互为等电子体,空间构型均为正四面体
(4)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)溶于水显弱酸性,但它却只是一元酸,可以用硼酸在水溶液中的电离平衡解释它只是一元弱酸的原因。
①H3BO3中B的原子杂化类型为 ;
②写出硼酸在水溶液中的电离方程式 。
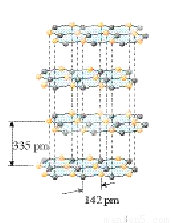
(5)硅与碳是同一主族元素,其中石墨为混合型晶体,已知石墨的层 间距为335pm,C-C键长为142pm,计算石墨晶体密度(要求写出计算过程,得出结果保留三位有效数字,NA为6.02×1023mol-1)
科目:gzhx 来源:不详 题型:填空题
| A.[Cu (NH3)4]SO4中所含的化学键有离子键、极性键和配位键 |
| B.在[Cu(NH3)4 ]2+中Cu2+给出孤对电子,NH3提供空轨道 |
| C.[Cu (NH3)4]SO4组成元素中第一电离能最大的是氧元素 |
| D.SO42-与PO43-互为等电子体,空间构型均为正四面体 |

科目:gzhx 来源: 题型:
 太阳能电池的发展已经进入了第三代.第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜铟镓硒CIGs(CIS中掺入Ga)等化合物薄膜太阳能电池以及薄膜Si系太阳能电池.
太阳能电池的发展已经进入了第三代.第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜铟镓硒CIGs(CIS中掺入Ga)等化合物薄膜太阳能电池以及薄膜Si系太阳能电池.科目:gzhx 来源: 题型:
 太阳能电池的发展已经进入了第三代.第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜铟镓硒CIGs(CIS中掺入Ga)等化合物薄膜太阳能电池以及薄膜Si系太阳能电池.
太阳能电池的发展已经进入了第三代.第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜铟镓硒CIGs(CIS中掺入Ga)等化合物薄膜太阳能电池以及薄膜Si系太阳能电池.科目:gzhx 来源: 题型:解答题
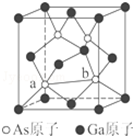 元素周期表第ⅤA族元素包括氮、磷、砷(As)、锑(Sb)等.这些元素无论在研制新型材料,还是在制作传统化肥、农药等方面都发挥了重要的作用.请回答下列问题:
元素周期表第ⅤA族元素包括氮、磷、砷(As)、锑(Sb)等.这些元素无论在研制新型材料,还是在制作传统化肥、农药等方面都发挥了重要的作用.请回答下列问题:科目:gzhx 来源: 题型:解答题
| 元素 | X | Y | Z | W |
| 相关信息 | 短周期p区元素,有种单质常作电极材料 | 基态原子2p能级上各轨道中均有电子且电子的自旋方向相同 | 基态原子的核外电子共有17种运动状态 | 位于第四周期第VA族 |
 (YH3作为一个整体写)
(YH3作为一个整体写)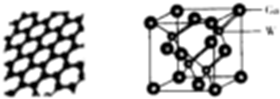
科目:gzhx 来源: 题型:解答题
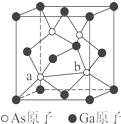 元素周期表第ⅤA族元素包括氮、磷、砷(As)、锑(Sb)等.这些元素无论在研制新型材料,还是在制作传统化肥、农药等方面都发挥了重要的作用.
元素周期表第ⅤA族元素包括氮、磷、砷(As)、锑(Sb)等.这些元素无论在研制新型材料,还是在制作传统化肥、农药等方面都发挥了重要的作用.科目:gzhx 来源: 题型:解答题
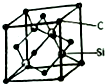 铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:
铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答: .
.科目:gzhx 来源: 题型:填空题
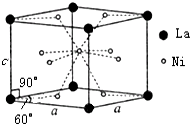 材料的开发、应用和发展是科技进步的结果,同时,材料的发展也促进了科技的进步和发展.
材料的开发、应用和发展是科技进步的结果,同时,材料的发展也促进了科技的进步和发展.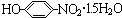 .
.科目:gzhx 来源: 题型:解答题

科目:gzhx 来源: 题型:解答题
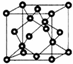 AIN是重要的半导体材料,Ga(镓)、P、As都是形成化合物半导体材料的重要元素.
AIN是重要的半导体材料,Ga(镓)、P、As都是形成化合物半导体材料的重要元素.科目:gzhx 来源: 题型:解答题
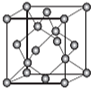 AIN是重要的半导体材料,Ga(镓)、P、As(砷)都是形成化合物半导体材料的重要元素.
AIN是重要的半导体材料,Ga(镓)、P、As(砷)都是形成化合物半导体材料的重要元素.