12.碘化钠在医药中用作甲状腺肿瘤防治剂、祛痰剂和利尿剂,也用作食品添加剂、感光剂等,工业上用水合肼(N
2H
4•H
2O)还原法制取碘化钠固体,其制备流程如图所示:
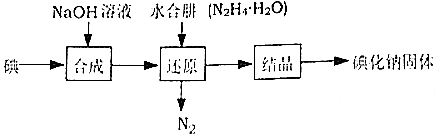
已知:N
2H
4•H
2O在100℃以上分解
(1)在合成NaI的过程中,可能混有的物质是NaIO
3,生产过程中要适当补充NaOH,目的是促使反应向生成物方向移动;
(2)在还原过程中,为了防止水合肼(N
2H
4•H
2O)高温分解,反应温度控制在60~70℃,温度也不能过低,其原因是温度过低,降低化学反应速率,工业上也可以用硫化钠或铁屑还原碘酸钠制备碘化钠,但水合肼还原法制得的产品纯度更高,其原因是N
2H
4•H
2O的氧化产物为N
2和H
2O,不引入杂质;
(3)请设计一个简单的实验来检验还原液中是否含有IO
3-:取适量还原液,加入淀粉溶液,加稀硫酸酸化,若溶液变蓝色,说明废水中含有IO
3-;若溶液不变蓝,说明废水中不含IO
3-[可供选择的试剂:稀硫酸、淀粉溶液、FeCl
3溶液]
(4)测定产品中NaI含量的实验步骤如下:
a.称取4.000g样品并溶解,在250mL容量瓶中定容;
b.量取25.00mL待测液于锥形瓶中,然后加入足量的FeCl
3溶液,充分反应后,再加入A溶液作指示剂;
c.用0.1000mol•L
-1的Na
2SO
4溶液滴定至终点(发生反应方程式为2Na
2S
2O
3+I
2═Na
2S
4O
6+2NaI),重复测定3次,所得的相关数据如表所示:
| 规定序号 | 待测体积/mL | 盛装标准滴定管的起点读数/mL | 盛装标准滴定管的终点读数/mL |
| 1 | 25.00 | 0.06 | 24.04 |
| 2 | 25.00 | 0.02 | 24.02 |
| 3 | 25.00 | 0.12 | 24.14 |
①在滴定过程中,Na
2S
2O
3溶液应放碱式滴定管(填仪器)中,加入的A物质为淀粉(填名称);
②滴定终点观察到的现象为溶液蓝色褪去,且半分钟内不恢复;
③该样品中NaI的含量为90%;
④若用上述方法测得NaI的含量偏低(忽略测定过程中的误差),则可能的原因是部分NaI被空气中O
2氧化;
(5)碘化钠固体的保存方法是用棕色瓶遮光、密封保存.


