
科目:gzhx 来源: 题型:解答题
科目:czhx 来源: 题型:
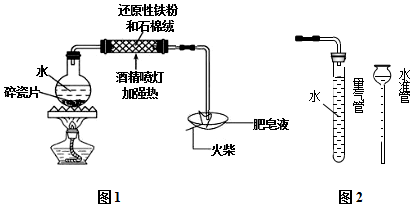
某校化学兴趣小组用如图所示装置对铁生锈的条件进行了探究.

请回答:
(1)检查装置的气密性:连接好装置,关闭分液漏斗的活塞,将末端导管接入到装有水的烧杯中,微热A装置,说明气密性良好的现象是 .
(2)A中反应的化学方程式为 .
(3)B中生石灰的作用是除去氧气中的水蒸气,其反应的化学方程式为 .
(4)4分钟后观察:C处铁丝依然光亮,D处铁丝表面灰暗,E中铁丝依然光亮.说明铁生锈主要与 、 有关.
(5)D、E处实验现象对比说明:决定铁生锈快慢的一个重要因素是 .
(6)请你列举一种防止钢铁腐蚀的方法: .
科目:czhx 来源:2013年山东省济南市长清区中考化学二模试卷(解析版) 题型:填空题

科目:czhx 来源: 题型:实验探究题
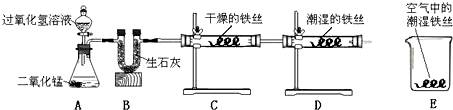
科目:czhx 来源: 题型:
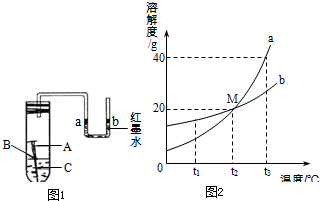 (1)某校化学兴趣小组用如图1所示装置探究铁制品锈蚀的条件.在盛有水的试管中放一根洁净的铁钉,用带U型管的胶塞塞紧,刚开始实验时,U型管内液面a、b两端处于同一水平高度.数天后,观察到:
(1)某校化学兴趣小组用如图1所示装置探究铁制品锈蚀的条件.在盛有水的试管中放一根洁净的铁钉,用带U型管的胶塞塞紧,刚开始实验时,U型管内液面a、b两端处于同一水平高度.数天后,观察到:科目:czhx 来源: 题型:解答题
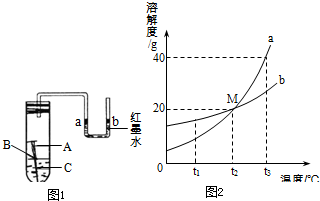 (1)某校化学兴趣小组用如图1所示装置探究铁制品锈蚀的条件.在盛有水的试管中放一根洁净的铁钉,用带U型管的胶塞塞紧,刚开始实验时,U型管内液面a、b两端处于同一水平高度.数天后,观察到:
(1)某校化学兴趣小组用如图1所示装置探究铁制品锈蚀的条件.在盛有水的试管中放一根洁净的铁钉,用带U型管的胶塞塞紧,刚开始实验时,U型管内液面a、b两端处于同一水平高度.数天后,观察到:科目:czhx 来源: 题型:

| ||
| ||
科目:czhx 来源: 题型:
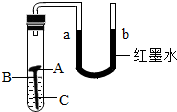 某校化学兴趣小组用如右图所示装置探究铁制品锈蚀的条件.在盛有水的试管中放一根洁净的铁钉,用带U型管的胶塞塞紧,刚开始实验时,U型管内液面a、b两端处于同一水平高度.数天后,观察到:
某校化学兴趣小组用如右图所示装置探究铁制品锈蚀的条件.在盛有水的试管中放一根洁净的铁钉,用带U型管的胶塞塞紧,刚开始实验时,U型管内液面a、b两端处于同一水平高度.数天后,观察到:科目:czhx 来源: 题型:
| 实验方法 | 实验操作 | 实验现象 | 实验结论 |
| 物理方法 | 假设二成立 | ||
| 化学方法 | 假设二成立 |
科目:gzhx 来源: 题型:阅读理解
 某化学兴趣小组查阅资料得知镁可在氮气中燃烧生成Mg3N2,并设计如下实验方案进行探究.
某化学兴趣小组查阅资料得知镁可在氮气中燃烧生成Mg3N2,并设计如下实验方案进行探究.| 实验操作 | 实验现象 | |
| 方案一 | 取已除去表面氧化膜的镁条和铝条, 分别和0.1mol•L-1HCl溶液反应 |
均有气泡产生,镁条反应 比铝条反应更剧烈 |
| 方案二 |
科目:czhx 来源: 题型:解答题

科目:czhx 来源:不详 题型:问答题

科目:czhx 来源:2013年吉林省白城市镇赉中学中考化学一模试卷(解析版) 题型:解答题

科目:gzhx 来源: 题型:解答题
 某化学兴趣小组为探究
某化学兴趣小组为探究科目:gzhx 来源:绵阳二模 题型:问答题
科目:czhx 来源: 题型:

| 实验操作 | 实验现象 | 实验结论及分析 |
| 取11.8g纯碱样品配成100mL溶液,取5mL于试管中,然后滴加过量的CaCl2溶液. | 产生白色沉淀 | 反应的化学方程式: 滴加的CaCl2溶液要过量的原因是 |
| 将反应后的混合物进行过滤,把获得的沉淀物进行洗涤、干燥、称量其质量为0.5g. | / | 样品中Na2CO3的质量分数为 (保留小数一位) |
科目:czhx 来源: 题型:


科目:gzhx 来源:2015-2016学年黑龙江大庆一中高二下第二次段考化学试卷(解析版) 题型:实验题
(一)某化学兴趣小组欲选用下列装置和药品制取纯净乙炔并进行有关乙炔性质的探究,试回答下列问题。
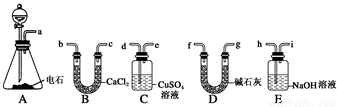
(1)A中制取乙炔的化学反应方程式为______________________。
(2)制乙炔时,旋开分液漏斗的活塞,使水缓慢滴下的原因是________________________,
通常用 代替蒸馏水.
(3)用电石制得的乙炔中常含有H2S、PH3等杂质,除去杂质应选用________(填序号,下同)装置,气体应从________进;干燥乙炔最好选用________装置。
(4) 制取乙炔时,为防止产生的泡沫涌入导气管,应 操作
(二)溴乙烷性质的探究:
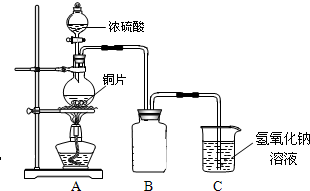
用如图实验装置(铁架台、酒精灯略) 验证溴乙烷的性质:
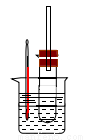
Ⅰ:在试管中加入10 mL6mol/L NaOH溶液和2 mL 溴乙烷,振荡。
II:将试管如图固定后,水浴加热。
(1)观察到___________现象时,表明溴乙烷与NaOH溶液已完全反应。
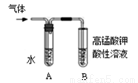
(2)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,将生成的气体通入如图装置。A试管中的水的作用是 ,若无A试管,B试管中的试剂应为 。
科目:czhx 来源: 题型:实验探究题

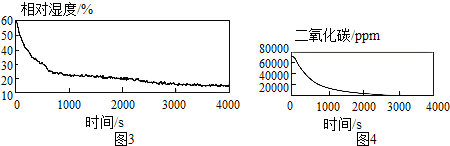


科目:czhx 来源: 题型:实验探究题
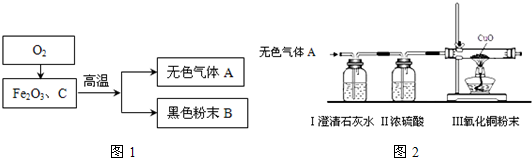
 某化学兴趣小组在实验室中模拟工业炼铁的原理,并探究CO与Fe2O3反应后的产物.所用装置如图所示.
某化学兴趣小组在实验室中模拟工业炼铁的原理,并探究CO与Fe2O3反应后的产物.所用装置如图所示.| 玻璃管中固体的质量 | 装置B试管及其中物质的总质量 | |
| 反应前 | 32g | 300g |
| 反应后 | 28.8g | 308g |