工业燃烧煤.石油等化石燃料释放出大量nox.co.co2等气体.严重污答案解析
科目:gzhx
来源:
题型:解答题
8.
工业燃烧煤、石油等化石燃料释放出大量NO
x、CO、CO
2等气体,严重污染空气,对废气进行脱硝,脱碳等处理可实现绿色环保、废物利用.
Ⅰ、脱硝:
已知:①H
2的热值为142.9kJ/g(热值是表示单位质量的燃料完全燃烧生成稳定的化合物时所放出的热量);
②N
2(g)+2O
2(g)═2NO
2(g)△H=+133kJ/mol
③H
2O(g)═H
2O(1)△H=-44kJ/mol
则催化剂存在下,H
2还原NO
2生成水蒸气和其他无毒物质的热化学方程式为4H
2(g )+2NO
2( g)=N
2(g )+4H
2O(g)△H=-1100.2KJ/mol;
Ⅱ、脱碳
(1)CO与空气可设计成燃料电池(以熔融的碳酸盐为电解质).写出该电池的负极反应式:CO-2e
-+CO
32-=2CO
2.
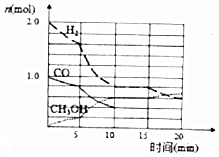
(2)甲醇是一种可再生能源,工业上可用合成气制备甲醇,反应为CO(g)+2H
2(g)⇌CH
3OH(g).某温度下在容积为VL的密闭容器中进行反应,其相关数据如图;反应开始至平衡时,用H
2表示化学反应速率为$\frac{0.12}{V}$mol ( L•min ).该温度下CO的平衡转化率为60%.
(3)向1L密闭容器中加入1molCO
2、3molH
2,在适当的条件下,发生反应CO
2(g)+3H
2(g)⇌CH
3OH(g)+H
2O(g).
①下列叙述能说明此反应达到平衡状态的是abe.
a.混合气体的平均相对分子质量保持不变
b.CO
2和H
2的体积分数保持不变
c.CO
2和H
2的转化率相等
d.混合气体的密度保持不变
e.1molCO
2生成的同时又3molH-H键断裂
②相同条件下,在容积都为1L且固定的两个密闭容器中,按如下方式加入反应物,一段时间后反应达到平衡.
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2、3molH2 | amol CO2、3amolH2
bmolCH3OH(g)、bmolH2O(g) |
若甲中平衡后气体的压强为开始的0.6倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆向反应方向进行,则b的取值可能为b (填序号)
a.0.7 b.0.9 c.1.2
若保持温度不变,起始加入0.5molCO
2、0.5molH
2、0.5molCH
3OH(g)、0.5molH
2O(g) 则此反应速率的关系:v
正> v
逆.(填“>”、“<”或“=”)
查看答案和解析>>

 工业燃烧煤、石油等化石燃料释放出大量NOx、CO、CO2等气体,严重污染空气,对废气进行脱硝,脱碳等处理可实现绿色环保、废物利用.
工业燃烧煤、石油等化石燃料释放出大量NOx、CO、CO2等气体,严重污染空气,对废气进行脱硝,脱碳等处理可实现绿色环保、废物利用.