
科目:czhx 来源: 题型:
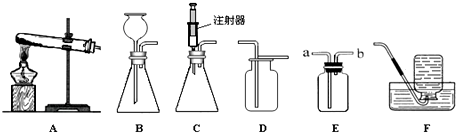
| ||
| ||
科目:czhx 来源:2007年山东省东营市中考真题化学卷 题型:020
| |||||||||||||||||||||||||
科目:czhx 来源: 题型:解答题


科目:czhx 来源:2006年苏州市初中毕业暨升学考试试卷 化学-新人教 题型:059
| |||||||||||||||||||||||||
科目:czhx 来源: 题型:
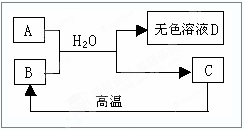
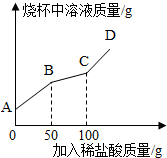
如图所示:A为含三种元素的钠盐,B为食品袋中常用作干燥剂的氧化物,C为相对分子质量为100白色不溶物,请填空:
(1)用化学式填空A ;
B ;
C 。
(2)D中一定含有的溶质是 ;理由是(用化学方程式表示) 。
(3)D还可能含的溶质是 。
科目:czhx 来源: 题型:阅读理解
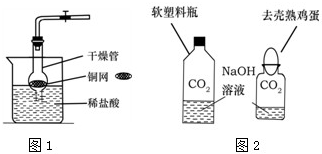 CO2是初中化学重点研究的气体之一.某化学兴趣小组设计了如下实验来探究CO2的制取和性质:
CO2是初中化学重点研究的气体之一.某化学兴趣小组设计了如下实验来探究CO2的制取和性质:| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 质量/g | 30 | 50 | 60 | 66 | 66 |
科目:czhx 来源: 题型:
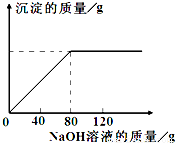
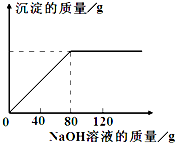 从海水中提出的食盐中主要含有氯化钠,还有少量的氯化镁杂质.现取仅含氯化镁杂质的氯化钠样品30.0g,完全溶解于95.8g水后,再加入质量分数为10%的氢氧化钠溶液.反应过程中生成沉淀的质量与氢氧化钠溶液的质量关系如图所示(反应为:MgCl2+2NaOH═Mg(OH)2↓+2NaCl).求:
从海水中提出的食盐中主要含有氯化钠,还有少量的氯化镁杂质.现取仅含氯化镁杂质的氯化钠样品30.0g,完全溶解于95.8g水后,再加入质量分数为10%的氢氧化钠溶液.反应过程中生成沉淀的质量与氢氧化钠溶液的质量关系如图所示(反应为:MgCl2+2NaOH═Mg(OH)2↓+2NaCl).求:科目:czhx 来源: 题型:阅读理解
 某制碱厂以岩盐水为主要原料生产纯碱(Na2CO3)和其他副产品.
某制碱厂以岩盐水为主要原料生产纯碱(Na2CO3)和其他副产品.| 温度/℃ | 0 | 10 | 20 | 30 | 40 | |
| 溶 解 度 /g |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| Na2SO4 | 4.5 | 9.6 | 20.2 | 40.8 | 48.4 | |
| CaCl2 | 59.5 | 65.0 | 74.5 | 100 | 116 | |
| MgCl2 | 52.9 | 53.8 | 54.8 | 56.0 | 58.0 | |
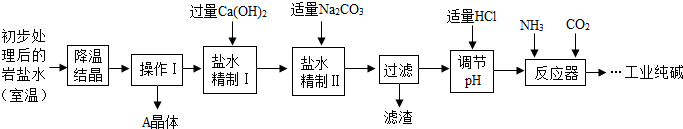
| 工业纯碱标准(Na 2CO3%≥) | ||
| 优等品 | 一等品 | 合格品 |
| 99.2 | 98.8 | 98.0 |
科目:czhx 来源:2012年北京市石景山区中考化学一模试卷(解析版) 题型:填空题
| 温度/℃ | 20 | 40 | 60 | 80 | 100 | ||
| 溶解度/g | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
| NH4Cl | 29.4 | 37.2 | 45.8 | 55.2 | 65.6 | 77.3 | |

科目:czhx 来源:2005-2006学年广东省九年级(上)第三次月考化学试卷(解析版) 题型:解答题
科目:czhx 来源:2013年北京市门头沟区中考化学二模试卷(解析版) 题型:选择题

科目:czhx 来源:2013年北京市平谷区初中毕业会考化学试卷(解析版) 题型:填空题
| 温度/℃ | 20 | 40 | 60 | 80 | 100 | ||
| 溶解度/g | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
| NH4Cl | 29.4 | 37.2 | 45.8 | 55.2 | 65.6 | 77.3 | |
科目:czhx 来源:2012年甘肃省定西市中考化学模拟试卷(九)(解析版) 题型:填空题
| 温度/℃ | 20 | 40 | 60 | 80 | 100 | ||
| 溶解度/g | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
| NH4Cl | 29.4 | 37.2 | 45.8 | 55.2 | 65.6 | 77.3 | |
科目:czhx 来源:安徽省中考真题 题型:单选题
科目:czhx 来源: 题型:
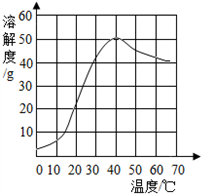
硫酸钠是一种重要的化工原料,其溶解度曲线如图所示。下列说法正确的是 ( )
A.硫酸钠的溶解度随温度升高而增大
B.30℃时硫酸钠饱和溶液的质量分数为40%
C.40℃时硫酸钠1{的溶解度约为50g
D.50℃时硫酸钠饱和溶液降温后一定饱和
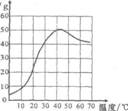
科目:czhx 来源: 题型:
硫酸钠是一种重要的化工原料,其溶解度曲线如图所示。下列说法正确的是
A.硫酸钠的溶解度随温度升高而增大
B.30℃时硫酸钠饱和溶液的质量分数为40%
c.40℃时硫酸钠1{的溶解度约为50g
D.50℃时硫酸钠饱和溶液降温后一定饱和
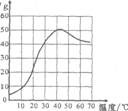
科目:czhx 来源: 题型:单选题
硫酸钠是一种重要的化工原料,其溶解度曲线如图所示。下列说法正确的是
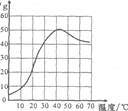
科目:czhx 来源: 题型:单选题
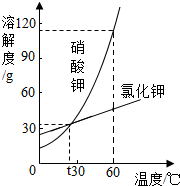 硝酸钾和氯化钾的溶解度曲线如图所示,下列叙述正确的是
硝酸钾和氯化钾的溶解度曲线如图所示,下列叙述正确的是