
科目:gzhx 来源:2012-2013学年湖北省襄阳市高三调研三月统一测试理综化学试卷(解析版) 题型:填空题
(14分) 电池的发明和应用是化学家们对人类社会的重要贡献之一。
Ⅰ.每一次化学电池技术的突破,都带来了电子设备革命性的发展。最近,我国在甲醇燃料电池的相关技术上获得了新突破,原理如下图1所示。
(1)请写出从C口通入O2发生的电极反应式 。
(2)以石墨做电极电解饱和食盐水,如下图2所示。电解开始后在 的周围(填“阴极”或“阳极”)先出现红色。假设电池的理论效率为80%(电池的理论效率是指电池产生的最大电能与电池反应所释放的全部能量之比),若消耗6.4g甲醇气体,外电路通过的电子个数为 (保留两位有效数字,NA取6.02×1023)。

Ⅱ.随着电池使用范围的日益扩大,废旧电池潜在的污染已引起社会各界的广泛关注。
(1)电池生产企业排放的工业废水中常含有Cu2+等重金属离子,直接排放会造成污染,目前在工业废水处理过程中,依据沉淀转化的原理,常用FeS等难溶物质作为沉淀剂除去这些离子。已知室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2。请用离子方程式说明上述除杂的原理 。
(2)工业上为了处理含有Cr2O72-的酸性工业废水,用绿矾(FeSO4·7H2O)把废水中的六价铬离子还原成三价铬离子,再加入过量的石灰水,使铬离子转变为Cr(OH)3沉淀。
①氧化还原过程的离子方程式为 。
②常温下,Cr(OH)3的溶度积Ksp=1×10-32 mol4·L-4,溶液的pH至少为 ,才能使Cr3+沉淀完全。
③现用上述方法处理100m3含铬(+6价)78mg•L-1的废水,需用绿矾的质量为 kg。(写出主要计算过程)
科目:gzhx 来源:2013-2014学年江苏省南通市高三第二次调研化学试卷(解析版) 题型:填空题
金属表面处理、皮革鞣制、印染等都可能造成铬污染。六价铬比三价铬毒性高,更易被人体吸收且在体内蓄积。
⑴工业上处理酸性含Cr2O72-废水的方法如下:
①向含Cr2O72-的酸性废水中加入FeSO4溶液,使Cr2O72-全部转化为Cr3+。写出该反应的离子方程式: 。
②调节溶液的pH,使Cr3+完全沉淀。实验室粗略测定溶液pH的方法为 ;25℃,若调节溶液的pH=8,则溶液中残余Cr3+的物质的量浓度为 mol/L。(已知25℃时,Ksp[Cr(OH)3]=6.3×10-31)
⑵铬元素总浓度的测定:准确移取25.00mL含Cr2O72-和Cr3+的酸性废水,向其中加入足量的(NH4)2S2O8溶液将Cr3+氧化成Cr2O72-,煮沸除去过量的(NH4)2S2O8;向上述溶液中加入过量的KI溶液,充分反应后,以淀粉为指示剂,向其中滴加0.015mol/L的Na2S2O3标准溶液,终点时消耗Na2S2O3溶液20.00mL。
计算废水中铬元素总浓度(单位:mg·L-1,写出计算过程)。
已知测定过程中发生的反应如下:
①2Cr3++3S2O82-+7H2O =Cr2O72-+6SO42-+14H+
②Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O
③I2+2S2O32-=2I-+S4O62-
科目:gzhx 来源:2012-2013学年黑龙江省高三10月月考化学试卷(解析版) 题型:填空题
(14分) (1) 2009年,长春应用化学研究所在甲醇燃料电池技术上获得新突破,原理如下图所示。
①请写出从C口通入O2发生的电极反应式___________________。
②以石墨电极电解饱和食盐水,电解开始后在______________的周围(填“阴极”或“阳极”)先出现红色。假设电池的理论效率为80%(电池的理论效率是指电池产生的最大电能与电池反应所释放的全部能量之比),若消耗6.4g甲醇气体,外电路通过的电子个数为__________________(保留两位有效数字)。
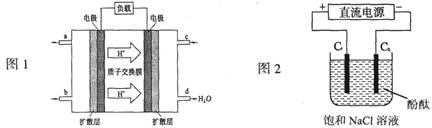
(2)工业废水中常含有Cu2+等重金属离子,直接排放会造成污染,目前在工业废水处理过程中,依据沉淀转化的原理,常用FeS等难溶物质作为沉淀剂除去这些离子。已知室温下Ksp(FeS)=6.3×10-18mol2•L-2,Ksp(CuS)=1.3×10-36mol2•L-2。
请用离子方程式说明上述除杂的原理___________________________________________。
(3)工业上为了处理含有Cr2O72-的酸性工业废水, 用绿矾(FeSO4·7H2O)把废水中的六价铬离子还原成三价铬离子,再加入过量的石灰水,使铬离子转变为Cr(OH)3沉淀。
①氧化还原过程的离子方程式为______________________________________________。
②常温下,Cr(OH)3的溶度积Ksp =1×10—32 mol4•L-4,溶液的pH至少为____,才能使Cr3+沉淀完全。
③现用上述方法处理100m3含铬(+6价)78mg•L—1的废水,需用绿矾的质量为 kg。(保留主要计算过程)
科目:gzhx 来源:2013届黑龙江省哈三中高三10月月考化学试卷(带解析) 题型:填空题
(14分) (1) 2009年,长春应用化学研究所在甲醇燃料电池技术上获得新突破,原理如下图所示。
①请写出从C口通入O2发生的电极反应式___________________。
②以石墨电极电解饱和食盐水,电解开始后在______________的周围(填“阴极”或“阳极”)先出现红色。假设电池的理论效率为80%(电池的理论效率是指电池产生的最大电能与电池反应所释放的全部能量之比),若消耗6.4g甲醇气体,外电路通过的电子个数为__________________(保留两位有效数字)。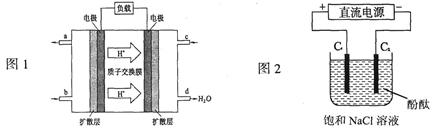
(2)工业废水中常含有Cu2+等重金属离子,直接排放会造成污染,目前在工业废水处理过程中,依据沉淀转化的原理,常用FeS等难溶物质作为沉淀剂除去这些离子。已知室温下Ksp(FeS)=6.3×10-18mol2•L-2,Ksp(CuS)=1.3×10-36mol2•L-2。
请用离子方程式说明上述除杂的原理___________________________________________。
(3)工业上为了处理含有Cr2O72-的酸性工业废水,用绿矾(FeSO4·7H2O)把废水中的六价铬离子还原成三价铬离子,再加入过量的石灰水,使铬离子转变为Cr(OH)3沉淀。
①氧化还原过程的离子方程式为______________________________________________。
②常温下,Cr(OH)3的溶度积Ksp =1×10—32 mol4•L-4,溶液的pH至少为____,才能使Cr3+沉淀完全。
③现用上述方法处理100m3含铬(+6价)78mg•L—1的废水,需用绿矾的质量为 kg。(保留主要计算过程)
科目:gzhx 来源:模拟题 题型:填空题
科目:gzhx 来源: 题型:阅读理解
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:
科目:gzhx 来源:2012-2013学年山西省高三10月月考理科化学试卷(解析版) 题型:选择题
2012年4月15日,央视《每周质量报告》报道某著名制药企业使用工业明胶制造有毒胶囊,其中铬元素含量超标。铬是人体必需的微量元素,它与脂类代谢有密切联系,能增强人体内胆固醇的分解和排泄,但铬过量会引起污染,危害人类健康。不同价态的铬毒性不同,三价铬对人体几乎无毒,六价铬的毒性为三价铬的100倍。下列叙述错误的是
A.污水中的Cr3+在溶解的氧气的作用下可被氧化为Cr2O72—
B.K2Cr2O7可以氧化乙醇,该反应可用于检查酒后驾驶
C.在反应Cr2O72—+I一+H+→Cr3++I2 +H2O中,氧化产物与还原产物的物质的量之比为3:2
D.发生铬中毒时,可服用维生素C缓解毒性,因为维生素C具有还原性
科目:gzhx 来源:2011-2012学年上海市高三上学期期中考试化学试卷 题型:填空题
六价铬[Cr(Ⅵ)]有剧毒,废水中的Cr2O 常用铁氧磁体法除去,即把过量的FeSO4•7H2O加入含Cr2O
常用铁氧磁体法除去,即把过量的FeSO4•7H2O加入含Cr2O 的废水中,调节pH<4,Fe2+还原Cr(Ⅵ)为Cr3+。
的废水中,调节pH<4,Fe2+还原Cr(Ⅵ)为Cr3+。
(1)写出Fe2+还原Cr2O 的离子方程式,并标明电子转移的方向和数目:
的离子方程式,并标明电子转移的方向和数目:
_________________________________________________________。
(2)调节(1)得到溶液的pH值为8~10,将析出相当于Fe(Ⅱ)[Fe(Ⅲ)xCr2-x]O4(磁性材料铁氧体)的沉淀,由(1)可确定x=_______。
(3)Cr3+在过量的NaOH溶液中会转化为CrO,写出这一转化的离子方程式_______________________________,由此可知Cr(OH)3呈_________(选填“酸”、“碱”或“两”)性。
科目:gzhx 来源: 题型:
六价铬对人体有毒,含铬废水要经过化学处理后才能排放,方法是用绿矾(FeSO4·7H2O)把废水中六价铬还原成三价铬离子,再加入过量的石灰水,使铬离子生成Cr(OH)3沉淀。
(1)配平下列主要反应的化学方程式。
![]() H2Cr2O7+
H2Cr2O7+![]() FeSO4+
FeSO4+![]() H2SO4——
H2SO4——![]() Fe2(SO4)3+
Fe2(SO4)3+![]() Cr2(SO4)3+
Cr2(SO4)3+![]() H2O
H2O
(2)处理后的沉淀中有Cr(OH)3外,还有__________________ (用化学式表示)。
(3)现在处理1×103 L含铬(+6)78 mg·L-1的废水,需要绿矾_________ g。
科目:gzhx 来源: 题型:
(1)配平下列主要反应的化学方程式。
![]() H2Cr2O7+
H2Cr2O7+![]() FeSO4+
FeSO4+![]() H2SO4——
H2SO4——![]() Fe2(SO4)3+
Fe2(SO4)3+![]() Cr2(SO4)3+
Cr2(SO4)3+![]() H2O
H2O
(2)处理后的沉淀中有Cr(OH)3外,还有__________________ (用化学式表示)。
(3)现在处理1×
科目:gzhx 来源:2011-2012年江苏省高二上学期开学考试化学试卷 题型:选择题
下列离子方程式书写不正确的是
A.用醋酸溶解碳酸钙:2CH3COOH+CaCO3=2CH3COO-+Ca2++CO2↑+H2O
B.碳酸氢铵溶液中加入足量热的氢氧化钠溶液:NH4++OH-=NH3↑+H2O
C.用氯酸钠的酸性溶液与H2O2作用制取ClO2:4ClO3-+4H2O2+4H+=4ClO2↑+3O2↑+6H2O
D.用硫酸酸化的桔红色的重铬酸钾(K2 Cr2O7)溶液与乙醇作用生成乙酸和草绿色三价铬,可用于检测是否酒后驾驶:2Cr2O72-+ 3C2H5OH + 16H+ → 4Cr3+ + 3CH3COOH + 11H2O
科目:gzhx 来源: 题型:
(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原成三价铁离子达到净水的目的。它是由硝酸铁、氢氧化钠和氯气在一定条件下制得的,同时还生成硝酸钠和氯化钠等。
① 写出制取高铁酸钠的化学方程式: ;
② 在制取高铁酸钠的反应中 元素被氧化;
③ 高铁酸钠杀菌作用是利用了其具有的 ,而净水作用的原因是 。
(2)在某化工厂生产中,要用到一种无色、可溶于水的晶体铝铵矾。该晶体是一种复盐,其主要化学成分为十二水合硫酸铝铵。向该复盐的溶液中逐滴加入氢氧化钠溶液,将发生一系列变化。已知,NH4+与AlO2-在水溶液中不能大量共存,会发生如下反应:NH4++A1O2-+H2O=Al(OH)3↓+ NH3↑ ,试回答:
① 硫酸铝铵在水溶液中的电离方程式为 ;
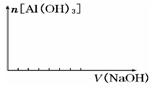
② 在向该复盐的溶液中逐滴加入氢氧化钠溶液,请在下图中画出加入氢氧化钠溶液的体积与沉淀物质的量之间的关系。
科目:gzhx 来源:2014届湖北省、黄石二中、鄂州高中高三11月联考化学试卷(解析版) 题型:选择题
铬是人体必需的微量元素,它与脂类代谢有密切联系,能增强人体内胆固醇的分解和排泄,但铬过量会引起污染,危害人类健康。不同价态的铬毒性不同,三价铬对人体几乎无毒,六价铬的毒性约为三价铬的100倍。下列叙述错误的是
A.发生铬中毒时,可服用维生素C缓解毒性,因为维生素C具有还原性
B.K2Cr2O7可以氧化乙醇,该反应可用于检查酒后驾驶
C.在反应Cr2O72-+I-+H+→Cr3++I2+H2O中,氧化产物与还原产物的物质的量之比为3∶2
D.污水中的Cr3+在溶解的氧气的作用下可被氧化为Cr2O72-
科目:gzhx 来源: 题型:
六价铬[Cr(Ⅵ)]有剧毒,废水中的Cr2O常用铁氧磁体法除去,即把过量的FeSO4•7H2O加入含Cr2O
的废水中,调节pH<4,Fe2+还原Cr(Ⅵ)为Cr3+。
(1)写出Fe2+还原Cr2O的离子方程式,并标明电子转移的方向和数目:
_________________________________________________________。
(2)调节(1)得到溶液的pH值为8~10,将析出相当于Fe(Ⅱ)[Fe(Ⅲ)xCr2-x]O4(磁性材料铁氧体)的沉淀,由(1)可确定x=_______。
(3)Cr3+在过量的NaOH溶液中会转化为CrO,写出这一转化的离子方程式_______________________________,由此可知Cr(OH)3呈_________(选填“酸”、“碱”或“两”)性。
科目:gzhx 来源: 题型:
(8分) (1)利用下列反应原理可以用于检查司机是否酒后开车。
2K2Cr2O7+3C2H5OH=2Cr2(SO4)3+3CH3COOH+2K2SO4+11H2O
(橙色) (酒精) (绿色)
①若司机酒后开车,检测器中的溶液显示出 色
②在反应中,铬元素被___________(填“氧化”或“还原”)
(2)一个体重50Kg的健康人,含铁2g。这2g铁在人体中不是以单质金属的形式存在的,而是以Fe2+和Fe3+的形式存在。二价铁离子易被吸收,给贫血者补充铁时,应给予含二价铁离子的二价铁盐,如硫酸亚铁(FeSO4)。服用维生素C,可使食物中的三价铁离子还原成二价铁离子,有利于铁的吸收。
这句话指出维生素C在这一反应中做 _______剂,具有 性。
科目:gzhx 来源: 题型:
(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原成三价铁离子达到净水的目的。它是由硝酸铁、氢氧化钠和氯气在一定条件下制得的,同时还生成硝酸钠和氯化钠等。
① 写出制取高铁酸钠的化学方程式: ;
② 在制取高铁酸钠的反应中 元素被氧化;
③ 高铁酸钠杀菌作用是利用了其具有的 ,而净水作用的原因是 。
(2)在某化工厂生产中,要用到一种无色、可溶于水的晶体铝铵矾。该晶体是一种复盐,其主要化学成分为十二水合硫酸铝铵。向该复盐的溶液中逐滴加入氢氧化钠溶液,将发生一系列变化。已知,NH4+与AlO2-在水溶液中不能大量共存,会发生如下反应:NH4++A1O2-+H2O=Al(OH)3↓+ NH3↑ ,试回答:
① 硫酸铝铵在水溶液中的电离方程式为 ;
② 在向该复盐的溶液中逐滴加入氢氧化钠溶液,请在下图中画出加入氢氧化钠溶液的体积与沉淀物质的量之间的关系。
科目:gzhx 来源: 题型:
工业上为了处理含有Cr2O72-的酸性工业废水,采用下列的处理方法: 是绿矾(FeSO4·7H2O),把废水中的六价铬离子还原成三价铬离子,再加入过量的石灰水,使铬离子转变为Cr(OH)3沉淀。其主要的化学方程式如下:
H2Cr2O7+6FeSO4+6 H2SO4=Cr2(SO4)3+3Fe 2(SO4)3+7H2O
现用上述方法处理1×104L含铬(+6价)78mg/L的废水(Cr相对原子质量为52),请回答下列问题:
⑴处理后,沉淀物中除Cr(OH)3外,还有 . (用化学式表示)。
⑵需用绿矾的质量 。